Calciumhypochlorit (Ca(ClO)2) ist eine chemische Verbindung, die häufig als Desinfektionsmittel und Bleichmittel verwendet wird. Es ist wirksam bei der Abtötung von Bakterien, Viren und Algen bei der Wasseraufbereitung und Abwasserentsorgung.
| IUPAC-Name | Calciumhypochlorit |
| Molekularformel | Ca(ClO)2 |
| CAS-Nummer | 7778-54-3 |
| Synonyme | Calciumsalz der unterchlorigen Säure, Bleichpulver, Chlorkalk, Calciumoxychlorid, HTH, Cal Hypo |
| InChI | InChI=1S/Ca.2ClO/c;2 1-2/q+2;2 -1 |
Eigenschaften von Calciumhypochlorit
Calciumhypochlorit-Formel
Calciumhypochlorit hat die chemische Formel Ca(ClO)2. Es ist ein weißer kristalliner Feststoff, der einen starken Chlorgeruch verströmt. Die Formel für Calciumhypochlorit zeigt, dass es ein Ca+2-Ion und zwei ClO–Ionen enthält. Das Hypochlorition ist negativ geladen und für die stark oxidierenden Eigenschaften der Verbindung verantwortlich.
Molmasse von Calciumhypochlorit
Die Molmasse von Ca(ClO)2 beträgt 142,98 g/mol. Sie wird berechnet, indem die Atommassen von Kalzium, Chlor und Sauerstoff addiert werden, die in einem Ca(ClO)2-Molekül vorhanden sind. Die Molmasse von Ca(ClO)2 ist ein wichtiger Parameter, der in verschiedenen chemischen Berechnungen verwendet wird.
Siedepunkt von Calciumhypochlorit
Ca(ClO)2 zersetzt sich, bevor es seinen Siedepunkt erreicht. Sein Siedepunkt ist daher nicht genau definiert. Wenn Ca(ClO)2 erhitzt wird, zersetzt es sich thermisch unter Bildung von Calciumchlorid, Sauerstoff und Chlorgas.
Schmelzpunkt von Calciumhypochlorit
Der Schmelzpunkt von Ca(ClO)2 beträgt 100°C. Bei dieser Temperatur schmilzt Ca(ClO)2 zu einer klaren Flüssigkeit. Ca(ClO)2 ist in Wasser sehr gut löslich und setzt beim Auflösen in Wasser Hypochloritionen frei, was es zu einem wirksamen Desinfektionsmittel macht.
Dichte von Calciumhypochlorit g/ml
Die Dichte von Ca(ClO)2 beträgt 2,35 g/ml. Es ist eine relativ dichte Verbindung und schwerer als Wasser. Die hohe Dichte von Ca(ClO)2 ist auf das Vorhandensein von Calciumionen in seinem Kristallgitter zurückzuführen.
Molekulargewicht von Calciumhypochlorit
Das Molekulargewicht von Ca(ClO)2 beträgt 142,98 g/mol. Sie wird berechnet, indem die Atommassen von Kalzium, Chlor und Sauerstoff addiert werden, die in einem Ca(ClO)2-Molekül vorhanden sind. Das Molekulargewicht von Ca(ClO)2 ist ein wichtiger Parameter, der in verschiedenen chemischen Berechnungen verwendet wird.
Struktur von Calciumhypochlorit
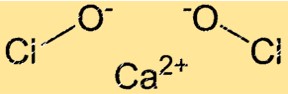
Ca(ClO)2 hat eine kristalline Struktur. Das Ca(ClO)2-Kristallgitter besteht aus Ca+2-Ionen und ClO–Ionen. Die ClO–Ionen sind in einer tetraedrischen Geometrie um die Ca+2-Ionen angeordnet. Die Kristallgitterstruktur von Ca(ClO)2 verleiht ihm seine stark oxidierenden Eigenschaften.
Löslichkeit von Calciumhypochlorit
Ca(ClO)2 ist in Wasser sehr gut löslich. Es löst sich in Wasser auf und bildet ein Hypochlorition und ein Calciumion. Die Löslichkeit von Ca(ClO)2 in Wasser nimmt mit steigender Temperatur zu. Ca(ClO)2 ist auch in organischen Lösungsmitteln wie Aceton und Ethanol löslich.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2,35 |
| Farbe | Weiß |
| Geruch | Chlorgeruch |
| Molmasse | 142,98 g/Mol |
| Dichte | 2,35 g/cm³ |
| Fusionspunkt | 100°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 21g/100ml (20°C) |
| Löslichkeit | Löslich in Aceton, Ethanol, Glycerin und Wasser |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 7.5 |
| pH-Wert | ~11 |
Sicherheit und Gefahren von Calciumhypochlorit
Ca(ClO)2 kann bei unsachgemäßer Handhabung gefährlich sein. Es ist ein starkes Oxidationsmittel, das heftig mit organischen Verbindungen reagieren und giftige Gase freisetzen kann. Es kann Haut- und Augenreizungen verursachen und eine längere Exposition kann zu Atemproblemen führen. Es sollte an einem kühlen, trockenen und gut belüfteten Ort, entfernt von organischen Stoffen, Reduktionsmitteln und Säuren, gelagert werden. Ca(ClO)2 sollte mit Vorsicht gehandhabt werden und beim Umgang sollte Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden. Es sollte nicht mit anderen Chemikalien, einschließlich Säuren oder Reduktionsmitteln, gemischt werden, da dies zu einer Explosion führen kann.
| Gefahrensymbole | O, Xi, N |
| Sicherheitsbeschreibung | Gesundheitsschädlich beim Verschlucken, verursacht Hautreizungen, verursacht schwere Augenreizungen und kann Krebs verursachen |
| UN-Identifikationsnummern | UN1748 |
| HS-Code | 2828.90.00 |
| Gefahrenklasse | 5.1 (Oxidationsmittel) |
| Verpackungsgruppe | II |
| Toxizität | LD50 (oral, Ratte) = 850 mg/kg; LC50 (Inhalation, Ratte) = 10,8 mg/m³ (4-stündige Exposition) |
Methoden zur Synthese von Calciumhypochlorit
Es gibt verschiedene Methoden zur Synthese von Ca(ClO)2.
Eine Methode besteht darin, Chlorgas mit gelöschtem Kalk, auch Calciumhydroxid genannt, in Wasser zu mischen. Bei der Reaktion entstehen Ca(ClO)2, Calciumchlorid und Wasser. Bei einer anderen Methode wird Chlorgas mit trockenem Calciumhydroxid umgesetzt, wodurch Ca(ClO)2 und Wasserdampf entstehen.
Der großtechnische Ca(ClO)2-Produktionsprozess beinhaltet typischerweise die Reaktion von Natriumhypochlorit mit Calciumchlorid , wodurch Ca(ClO)2 und Natriumchlorid entstehen.
Eine andere Methode besteht darin, Calciumcarbonat mit Chlorgas in Gegenwart von Wasser oder Essigsäure umzusetzen. Bei der Reaktion entstehen Ca(ClO)2, Kohlendioxid, Wasser oder Calciumacetat und Salzsäure.
Diese Methoden erfordern eine sorgfältige Handhabung und geeignete Ausrüstung, um Sicherheit und Wirksamkeit zu gewährleisten. Die Wahl der Methode hängt vom Produktionsumfang und der gewünschten Reinheit des Endprodukts ab.
Verwendung von Calciumhypochlorit
Ca(ClO)2 ist aufgrund seiner starken oxidierenden und desinfizierenden Eigenschaften vielseitig einsetzbar. Hier sind einige häufige Verwendungen von Ca(ClO)2:
- Wasseraufbereitung: Wird häufig zur Desinfektion von Wasser in Schwimmbädern, Trinkwassersystemen und Abwasseraufbereitungsanlagen eingesetzt.
- Bleichmittel: Wird als Bleichmittel für Baumwolle, Leinen und Papierzellstoff sowie in der Papier- und Textilherstellung verwendet.
- Desinfektion: Wird häufig zur Desinfektion von Oberflächen und Geräten in der Lebensmittelindustrie verwendet.
- Desodorierung: Wird verwendet, um unangenehme Gerüche aus Stoffen, Teppichen und anderen Materialien zu entfernen.
- Desinfektionsmittel: Wirksames Desinfektionsmittel für Krankenhäuser, Labore und andere Gesundheitseinrichtungen.
- Algenbekämpfung: Wird zur Bekämpfung des Algenwachstums in Gewässern wie Teichen und Seen eingesetzt.
- Chemische Synthese: Wird bei der Synthese verschiedener organischer und anorganischer Verbindungen verwendet.
- Verwendung im Haushalt: Wird als Haushaltsdesinfektionsmittel verwendet, insbesondere zum Reinigen und Desinfizieren von Toiletten und Rohren.
- Erdölbohrungen: Wird auch bei Erdölbohrungen verwendet, um das Wachstum von Bakterien und anderen Mikroorganismen zu verhindern.
Fragen:
F: Kann man Kalziumhypochlorit zum Entfernen einer Tätowierung verwenden?
A: Nein, Ca(ClO)2 sollte nicht zum Entfernen einer Tätowierung verwendet werden. Es ist ein starkes Oxidationsmittel, das schwere Hautschäden und Narbenbildung verursachen kann.
F: Wie lagere ich Calciumhypochlorit?
A: Ca(ClO)2 sollte an einem kühlen, trockenen und gut belüfteten Ort gelagert werden, fern von direkter Sonneneinstrahlung, Wärmequellen und unverträglichen Substanzen. Es muss in einem gut verschlossenen Behälter aufbewahrt und vor Feuchtigkeit und Wasser geschützt werden.
F: Wo kann man Calciumhypochlorit kaufen?
A: Ca(ClO)2 kann bei Chemielieferanten, Schwimmbadbedarfsgeschäften und Online-Händlern erworben werden.
F: Wie viel Calciumhypochlorit für das Trinkwasser?
A: Die für die Trinkwasseraufbereitung erforderliche Menge an Ca(ClO)2 hängt von der Konzentration der Lösung und dem aufzubereitenden Wasservolumen ab. Die empfohlene Dosierung für die regelmäßige Desinfektion liegt im Allgemeinen zwischen 0,2 und 0,5 ppm (parts per million).
F: Wie viel Calciumhypochlorit kann sicher eingenommen werden?
A: Ca(ClO)2 sollte niemals eingenommen werden, da es hochgiftig ist und schwere Gesundheitsprobleme oder sogar den Tod verursachen kann.
F: Wasserreinigung mit Calciumhypochlorit?
A: Ca(ClO)2 wird häufig zur Wasserreinigung und -desinfektion in einer Vielzahl von Umgebungen verwendet, darunter Schwimmbäder, Trinkwassersysteme und Abwasseraufbereitungsanlagen.
F: Calciumhypochlorit-Schock?
A: Beim Ca(ClO)2-Schock handelt es sich um einen Prozess, bei dem einem Pool oder Spa eine höhere Konzentration an Ca(ClO)2 zugesetzt wird, um den Chlorgehalt schnell zu erhöhen und schädliche Bakterien und Verunreinigungen zu beseitigen.
F: Calciumhypochlorit zur Desinfektion von Wasser?
A: Ca(ClO)2 ist ein starkes Desinfektionsmittel, das häufig zur Wasseraufbereitung und -reinigung verwendet wird, um Bakterien, Viren und andere schädliche Mikroorganismen zu beseitigen.
F: Ist Ca(OCl)2 eine Säure oder eine Base?
A: Calciumhypochlorit (Ca(OCl)2) ist eine Base, da es ein Proton aufnehmen kann, um ein Hydroxidion zu bilden.
F: Welche reduzierte Form von Ca(OCl)2 bleibt am Ende des Experiments übrig?
A: Die reduzierte Form von Ca(OCl)2, die am Ende eines Experiments übrig bleibt, hängt von der spezifischen Reaktion ab, die stattfindet. In manchen Fällen kann es sich um Calciumchlorid (CaCl2) oder Calciumcarbonat (CaCO3) handeln.
