Natriummetabisulfit (Na2S2O5) ist eine chemische Verbindung, die als Konservierungsmittel und Antioxidans in Lebensmitteln und Getränken verwendet wird. Es kann auch als Desinfektions- und Bleichmittel in verschiedenen Branchen eingesetzt werden.
| IUPAC-Name | Natriumpyrosulfit |
| Molekularformel | Na2S2O5 |
| CAS-Nummer | 7681-57-4 |
| Synonyme | Dinatriumdisulfit, pyroschwefelige Säure, Dinatriumsalz, Natriumpyrosulfit, Natriumdisulfit |
| InChI | InChI=1S/2Na.H2O5S2/c;;1-6(2)7(3,4)5/h;;(H,1,2)(H,3,4,5)/q2*+1; /p-2 |
Eigenschaften von Natriummetabisulfit
Natriummetabisulfit-Formel
Die chemische Formel für Natriummetabisulfit lautet Na2S2O5. Es besteht aus zwei Natriumionen (Na+) und einem Disulfit-Ion (S2O5-2). Die Verbindung ist ein weißes oder gelbliches kristallines Pulver, das in Wasser löslich ist und einen stechenden Geruch verströmt.
Molmasse von Natriummetabisulfit
Die Molmasse von Na2S2O5 beträgt 190,107 g/mol. Dieser Wert wird durch Addition der Atommassen der Elemente in der Verbindung berechnet, die für Natrium 22,99 g/mol, für Schwefel 32,06 g/mol und für Sauerstoff 15,99 g/mol betragen. Die Molmasse ist eine wichtige Eigenschaft, die dabei hilft, zu bestimmen, wie viel einer Substanz für eine chemische Reaktion benötigt wird.
Siedepunkt von Natriummetabisulfit
Na2S2O5 hat einen hohen Schmelzpunkt von 150 °C, zersetzt sich jedoch, bevor es sieden kann. Die Verbindung zerfällt bei einer Temperatur von etwa 150 °C in Schwefeldioxid (SO2) und Natriumsulfit (Na2SO3). Daher ist der Siedepunkt von Na2S2O5 nicht anwendbar.
Natriummetabisulfit Schmelzpunkt
Der Schmelzpunkt von Na2S2O5 liegt bei 150°C. Bei dieser Temperatur vollzieht die Verbindung einen Phasenwechsel von fest zu flüssig. Der Schmelzpunkt ist eine wichtige physikalische Eigenschaft, die bei der Identifizierung und Charakterisierung eines Stoffes hilft.
Dichte von Natriummetabisulfit g/ml
Die Dichte von Na2S2O5 beträgt 1,48 g/ml. Es ist eine relativ dichte Verbindung, die im Wasser versinkt. Die Dichte einer Substanz ist die Masse pro Volumeneinheit und eine wichtige physikalische Eigenschaft, die dabei hilft, zu bestimmen, wie viel von einer Substanz in einem bestimmten Volumen enthalten ist.
Molekulargewicht von Natriummetabisulfit
Das Molekulargewicht von Na2S2O5 beträgt 190,107 g/mol. Es ist die Summe der Atomgewichte aller Atome in der Verbindung. Das Molekulargewicht ist eine wichtige Eigenschaft, die dabei hilft, die Menge einer Substanz zu berechnen, die für eine chemische Reaktion benötigt wird.
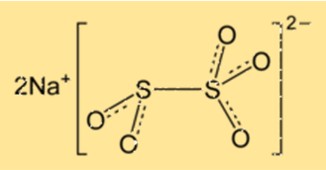
Struktur von Natriummetabisulfit
Na2S2O5 hat eine Kristallstruktur und gehört zum orthorhombischen Kristallsystem. Das Kristallgitter besteht aus Natriumionen und Disulfit-Ionen, die in einem sich wiederholenden Muster angeordnet sind. Die Verbindung hat eine tetraedrische Molekülgeometrie, wobei sich die Schwefelatome im Zentrum des Tetraeders befinden.
Löslichkeit von Natriummetabisulfit
Na2S2O5 ist in Wasser gut löslich, mit einer Löslichkeit von 54 g/100 ml bei 25 °C. Es ist auch in Glycerin löslich und in Ethanol schwer löslich. Die Löslichkeit eines Stoffes ist eine wichtige Eigenschaft, die seine Fähigkeit bestimmt, sich in einem bestimmten Lösungsmittel aufzulösen.
| Aussehen | Weißes oder gelbliches kristallines Pulver |
| Spezifisches Gewicht | 1,48 |
| Farbe | Weiß bis gelblich |
| Geruch | Acre |
| Molmasse | 190,107 g/Mol |
| Dichte | 1,48 g/ml |
| Fusionspunkt | 150°C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 54 g/100 ml bei 25 °C |
| Löslichkeit | Löslich in Glycerin und schwer löslich in Ethanol |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | 7.2 |
| pH-Wert | 4,5 (5%ige Lösung) |
Sicherheit und Gefahren von Natriummetabisulfit
Na2S2O5 kann bei unsachgemäßer Handhabung gefährlich sein. Es handelt sich um ein starkes Reduktionsmittel, das bei Kontakt Reizungen der Haut, der Augen und der Atemwege hervorrufen kann. Die Einnahme der Verbindung kann zu schweren Magen-Darm-Beschwerden führen. Na2S2O5 sollte an einem kühlen, trockenen und gut belüfteten Ort, entfernt von inkompatiblen Materialien, gelagert werden. Es sollte nicht mit starken Säuren, starken Oxidationsmitteln oder Reduktionsmitteln gemischt werden. Beim Umgang mit der Verbindung sollte Schutzausrüstung wie Handschuhe, Schutzbrillen und Atemschutzgeräte getragen werden. Im Falle eines Unfalls sollten Notfallmaßnahmen wie Augenspülstationen und Feuerlöscher leicht verfügbar sein.
| Gefahrensymbole | Xi (irritierend) |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. Tragen Sie Schutzkleidung und Handschuhe. Nicht einnehmen. Bei ausreichender Belüftung verwenden. |
| UN-Identifikationsnummern | UN 2676 |
| HS-Code | 2832.10.00 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | III |
| Toxizität | LD50 (oral, Ratte): 1.000 mg/kg; LC50 (Inhalation, Ratte): 11 mg/L (4 Stunden) |
Methoden zur Synthese von Natriummetabisulfit
Na2S2O5 kann durch verschiedene Methoden synthetisiert werden, einschließlich der Reaktion von Natriumbisulfit mit Schwefeldioxid in Gegenwart eines Oxidationsmittels wie Wasserstoffperoxid . Der Prozess erhitzt das Addukt aus Natriumbisulfit und Schwefeldioxid, um Na2S2O5 zu bilden.
Eine andere Methode beinhaltet die Reaktion von Natriumhydroxid mit Schwefeldioxidgas, gefolgt von der Zugabe von Schwefelsäure, um Natriumsulfat und Na2S2O5 zu bilden.
Eine andere Synthesemethode besteht darin, Natriumcarbonat mit Schwefeldioxid zur Reaktion zu bringen und das resultierende Natriumsulfit dann in Gegenwart von Luft zu erhitzen. Bei diesem Prozess entstehen Natriumsulfat und Na2S2O5.
In Gegenwart eines Oxidationsmittels wie Wasserstoffperoxid oder Salpetersäure kann Na2S2O5 durch Reaktion von Schwefel mit Natriumsulfit hergestellt werden.
In der Industrie besteht die gebräuchlichste Methode zur Synthese von Na2S2O5 darin, Natriumbisulfit mit Schwefeldioxid in Gegenwart eines Katalysators wie Mangandioxid umzusetzen. Durch Erhitzen des Natriumbisulfit/Schwefeldioxid-Addukts entsteht Na2S2O5.
Verwendung von Natriummetabisulfit
Na2S2O5 wird aufgrund seiner stark reduzierenden Eigenschaften und seiner Fähigkeit, als Konservierungsmittel und Antioxidans zu wirken, in verschiedenen Branchen vielfältig eingesetzt. Zu den häufigsten Anwendungen von Na2S2O5 gehören:
- Lebensmittel- und Getränkeindustrie: Wird häufig als Konservierungsmittel und Antioxidans in Lebensmittel- und Getränkeprodukten wie Wein, Bier, Fruchtsäften und Trockenfrüchten verwendet. Dies trägt dazu bei, den Verderb und die Oxidation dieser Produkte zu verhindern und so ihre Haltbarkeit zu verlängern.
- Pharmazeutische Industrie: Wird als Antioxidans in verschiedenen pharmazeutischen Produkten wie Cremes, Salben und Tabletten verwendet. Es trägt dazu bei, den Zerfall dieser Produkte durch Luft- und Lichteinwirkung zu verhindern.
- Wasseraufbereitung: Wird zur Entchlorung von Wasser in Wasseraufbereitungsanlagen verwendet. Es hilft, überschüssiges Chlor und Chloramine zu beseitigen, die für Wasserlebewesen schädlich sein können.
- Fotografie: Wird als fotografischer Entwickler und Fixierer in der Fotoindustrie verwendet. Es trägt dazu bei, die Silberionen zu metallischem Silber zu reduzieren und so das fotografische Bild zu erzeugen.
- Textilindustrie: Wird in der Textilindustrie als Reduktionsmittel für Färbe- und Druckprozesse verwendet. Es trägt dazu bei, überschüssigen Sauerstoff aus der Farbstofflösung zu entfernen und so die Farbintensität und -gleichmäßigkeit zu verbessern.
Fragen:
F: Wo kann ich Natriummetabisulfit vor Ort kaufen?
A: Na2S2O5 ist normalerweise in Chemiegeschäften oder Online-Händlern erhältlich. Möglicherweise ist es auch in einigen Lebensmittelfachgeschäften erhältlich, da es in der Lebensmittelindustrie häufig als Konservierungsmittel verwendet wird.
F: Wo kann man Natriummetabisulfit kaufen?
A: Na2S2O5 kann in Chemiegeschäften oder im Online-Einzelhandel für Spezialchemikalien gekauft werden. Möglicherweise ist es auch in einigen Lebensmittelfachgeschäften erhältlich.
F: Ist Natriummetabisulfit sicher?
A: Na2S2O5 kann gefährlich sein, wenn es nicht richtig gehandhabt wird. Beim Umgang mit dieser Verbindung ist es wichtig, geeignete Schutzausrüstung zu tragen und Sicherheitsvorkehrungen zu befolgen. Es kann zu Haut- und Augenreizungen führen und in Verbindung mit Säure auch giftiges Schwefeldioxid freisetzen. Bei Verwendung in geeigneten Konzentrationen und sorgfältiger Handhabung gilt Na2S2O5 jedoch im Allgemeinen als sicher für den vorgesehenen Verwendungszweck.
F: Kann man Natriumbisulfat in Natriummetabisulfit umwandeln?
A: Ja, Natriumbisulfat (NaHSO4) kann in Na2S2O5 umgewandelt werden, indem es in Gegenwart eines Oxidationsmittels wie Wasserstoffperoxid auf hohe Temperaturen erhitzt wird. Die Reaktion führt zur Freisetzung von Wasser und zur Bildung von Na2S2O5.
F: Was ist der Unterschied zwischen Natriumbisulfit und Natriummetabisulfit?
A: Der Hauptunterschied zwischen NaHSO3 und Na2S2O5 ist ihre chemische Struktur. Natriumbisulfit hat eine Sulfitgruppe (-SO3) und ein Wasserstoffion (H+), während Na2S2O5 zwei miteinander verbundene Sulfitgruppen (-SO3) aufweist. Na2S2O5 ist außerdem stabiler und länger haltbar als Natriumbisulfit.
F: Wie hoch ist die Oxidationszahl von S in Na2S2O5?
A: Die Oxidationszahl von Schwefel (S) in Na2S2O5 beträgt +5.
F: Wie ermittelt man die Konzentration von IO3- aus KIO3 und Na2S2O5?
A: Die Konzentration von IO3- kann durch Titration mit einer bekannten Konzentration von Natriumthiosulfat (Na2S2O3) unter Verwendung von Stärke als Indikator bestimmt werden. Bei der Reaktion zwischen KIO3 und Na2S2O5 entsteht Jod (I2), das mit Na2S2O3 zu NaI und Na2S4O6 reagiert. Durch Messung des Volumens von Na2S2O3, das zur Reaktion mit Jod benötigt wird, kann die Konzentration von IO3- berechnet werden.
F: Welche Ionen enthält Na2S2O5?
A: Na2S2O5 besteht aus zwei Natriumionen (Na+) und einem Disulfit-Ion (-S2O5).
