Natriumhydrosulfit (Na2S2O4) ist ein weißes kristallines Pulver, das als Reduktionsmittel in verschiedenen Branchen wie der Textil- und Papierindustrie verwendet wird. Es entfernt Farbe von Stoffen und Papierbrei.
| IUPAC-Name | Natriumdithionit |
| Molekularformel | Na2S2O4 |
| CAS-Nummer | 7775-14-6 |
| Synonyme | Natriumhyposulfit, Natriumdithionat, Natriumsulfoxylat, Natriumhydrogensulfit |
| InChI | InChI=1S/2Na.H2O4S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Eigenschaften von Natriumhydrosulfit
Natriumhydrosulfit-Formel
Die chemische Formel für Natriumhydrosulfit lautet Na2S2O4. Das bedeutet, dass jedes Molekül Natriumhydrosulfit zwei Natriumatome, zwei Schwefelatome und vier Sauerstoffatome enthält. Die Formel besagt, dass die Verbindung aus positiv geladenen Natriumionen und negativ geladenen Sulfitionen besteht.
Natriumhydrosulfit Molmasse
Die Molmasse von Na2S2O4 beträgt 174,11 g/mol. Dieser Wert wird durch Addition der Atommassen der in einem Na2S2O4-Molekül vorhandenen Elemente berechnet. Die Molmasse ist ein wichtiger Parameter in der Stöchiometrie und wird zur Berechnung der Substanzmenge in einer bestimmten Probe der Verbindung verwendet.
Siedepunkt von Natriumhydrosulfit
Na2S2O4 ist eine stabile Verbindung und hat keinen Siedepunkt. Stattdessen zersetzt es sich beim Erhitzen über 150 °C und setzt dabei Schwefeldioxid und Wasserdampf frei. Die Zersetzungsreaktion ist exotherm und beim Erhitzen von Na2S2O4 ist Vorsicht geboten.
Schmelzpunkt von Natriumhydrosulfit
Der Schmelzpunkt von Na2S2O4 liegt bei 300°C. Bei dieser Temperatur schmilzt die feste Verbindung zu einer farblosen Flüssigkeit. Der Schmelzpunkt ist ein wichtiger Parameter zur Bestimmung der Stabilität der Verbindung und ihrer Eignung für verschiedene Anwendungen.
Dichte von Natriumhydrosulfit g/ml
Die Dichte von Na2S2O4 beträgt 1,48 g/ml. Dieser Wert weist darauf hin, dass Na2S2O4 im Vergleich zu Wasser eine relativ dichte Verbindung ist. Die Dichte ist ein wichtiger Parameter zur Bestimmung der Löslichkeit der Verbindung und ihrer Fähigkeit, sich mit anderen Substanzen zu mischen.
Molekulargewicht von Natriumhydrosulfit
Das Molekulargewicht von Na2S2O4 beträgt 174,11 g/mol. Dieser Wert wird durch Addition der Atommassen der in einem Na2S2O4-Molekül vorhandenen Elemente berechnet. Das Molekulargewicht ist ein wichtiger Parameter zur Bestimmung der Substanzmenge in einer bestimmten Probe der Verbindung.
Struktur von Natriumhydrosulfit
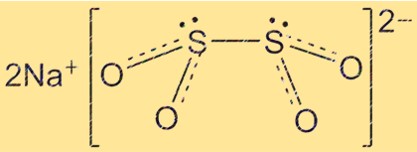
Die Struktur von Na2S2O4 ist tetraedrisch, wobei sich die Schwefelatome an den Ecken des Tetraeders befinden und die Sauerstoffatome die Kanten bilden. Im Zentrum des Tetraeders befinden sich Natriumionen. Die Struktur von Na2S2O4 ist wichtig für das Verständnis seiner chemischen und physikalischen Eigenschaften.
Löslichkeit von Natriumhydrosulfit
Na2S2O4 ist in Wasser gut löslich, mit einer Löslichkeit von 58 g/100 ml bei 20 °C. Die Löslichkeit wird durch Temperatur und pH-Wert beeinflusst, wobei eine höhere Löslichkeit bei höheren Temperaturen und niedrigeren pH-Werten beobachtet wird. Die hohe Löslichkeit von Na2S2O4 macht es in verschiedenen Anwendungen nützlich, beispielsweise in der Textil- und Papierindustrie, wo es als Reduktionsmittel eingesetzt wird.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 1,48 |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 174,11 g/Mol |
| Dichte | 1,48 g/ml |
| Fusionspunkt | 300°C |
| Siedepunkt | Zersetzt sich bei 150°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Wasser, Glycerin, Ethanol |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 6.6 |
| pH-Wert | 7-8 (1%ige Lösung) |
Sicherheit und Gefahren von Natriumhydrosulfit
Na2S2O4 ist im Allgemeinen sicher, wenn es richtig gehandhabt und verwendet wird, kann jedoch bei falscher Handhabung oder unsachgemäßer Verwendung einige Gefahren bergen. Es ist als Gefahrstoff eingestuft und kann bei Kontakt mit diesen Körperteilen Haut- und Augenreizungen hervorrufen. Auch das Einatmen von Na2S2O4-Staub oder -Nebel kann die Atemwege reizen. Na2S2O4 ist außerdem ein Reduktionsmittel, das heißt, es kann mit anderen Chemikalien reagieren und brennbare oder explosive Gase erzeugen. Um Unfälle und Verletzungen zu vermeiden, müssen geeignete Sicherheitsmaßnahmen wie das Tragen von Schutzausrüstung und der Umgang mit dem Stoff in gut belüfteten Bereichen befolgt werden.
| Gefahrensymbole | XI, C |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. Staub oder Nebel nicht einatmen. Schutzausrüstung tragen. In gut belüfteten Bereichen handhaben. |
| UN-Identifikationsnummern | UN1384 |
| HS-Code | 28311000 |
| Gefahrenklasse | 4.2 |
| Verpackungsgruppe | III |
| Toxizität | LD50: 1.520 mg/kg (oral, Ratte); LC50: 1840 ppm/4h (Inhalation, Ratte) |
Methoden zur Synthese von Natriumhydrosulfit
Es gibt verschiedene Methoden zur Synthese von Na2S2O4, die gebräuchlichste beinhaltet jedoch die Reaktion von Natriumbisulfit und Natriumdithionit.
Eine Methode beinhaltet die Zugabe von Natriumbisulfit zu einer Lösung aus Natriumhydroxid und Natriumdithionit, während eine andere Methode das Erhitzen einer Mischung aus Natriumbisulfit und Natriumdithionit beinhaltet.
Durch die Bildung von Na2S2O4 entsteht ein weißes kristallines Pulver, das mit beiden Methoden gesammelt und gereinigt werden kann.
Eine weitere Methode zur Synthese von Na2S2O4 beinhaltet die Reaktion zwischen Schwefeldioxid und Natriumborhydrid . Bei der Reaktion entstehen Na2S2O4 sowie Natriumborat und Wasserstoffgas. Diese Methode ist im Allgemeinen weniger verbreitet als die Natriumbisulfit- und Natriumdithionit-Methoden.
Verwendung von Natriumhydrosulfit
Aufgrund seiner einzigartigen Eigenschaften findet Na2S2O4 vielfältige Verwendungsmöglichkeiten in verschiedenen Branchen. Hier sind einige seiner Verwendungsmöglichkeiten:
- Textilindustrie: Wird in der Textilindustrie als Reduktionsmittel verwendet, um überschüssiges Färben und Bleichen aus Stoffen zu entfernen.
- Papierindustrie: Wird in der Papierindustrie zum Bleichen von Zellstoff und Papierprodukten verwendet.
- Lebensmittelindustrie: Wird als Lebensmittelzusatzstoff zur Verhinderung von Verfärbungen und als Konservierungsmittel in Obst- und Gemüsekonserven verwendet.
- Wasseraufbereitung: Wird zur Entfernung von überschüssigem Chlor bei der Aufbereitung von Trink- und Abwasser verwendet.
- Bergbauindustrie: Wird in der Bergbauindustrie zur Trennung von Kupfer- und Molybdänerzen verwendet.
- Polymerindustrie: Wird in der Polymerindustrie verwendet, um die Farbe von Polymeren und Kunststoffen zu reduzieren.
- Fotoindustrie: Wird in der Fotoindustrie als fotografisches Fixiermittel zur Entfernung unbelichteter Silberhalogenide aus Fotoabzügen verwendet.
- Andere industrielle Anwendungen: Wird in verschiedenen anderen Industrien verwendet, beispielsweise in der Lederverarbeitung, bei der Ölförderung und als Reduktionsmittel bei chemischen Synthesereaktionen.
Fragen:
F: Welcher Reiniger enthält Natriumhydrosulfit?
A: Na2S2O4 wird häufig in Haushaltsreinigern zur Fleckenentfernung und als Alternative zu Bleichmitteln verwendet.
F: Welche Funktion hat Natriumhydrosulfit bei der Reaktion mit Indigo?
A: Na2S2O4 wirkt bei der Reaktion mit Indigo als Reduktionsmittel, das den unlöslichen indigoblauen Farbstoff in eine lösliche, farblose Verbindung umwandelt.
F: Wo kann man Natriumhydrosulfit kaufen?
A: Na2S2O4 kann von Chemielieferanten wie Sigma-Aldrich, Fisher Scientific und VWR International bezogen werden.
F: Wie neutralisiert man Natriumhydrosulfit?
A: Na2S2O4 kann mit Natriumhydroxid oder einer anderen starken Base neutralisiert werden.
F: Welche indischen Lebensmittel verwenden Natriumhydrosulfit?
A: Na2S2O4 wird in indischen Lebensmitteln nicht häufig verwendet.
F: Wie wird Natriumhydrosulfit weiß?
A: Na2S2O4 wirkt als Reduktionsmittel und zerstört die chemischen Bindungen, die dem Material Farbe verleihen, wodurch die Farbe verschwindet und es zum Ausbleichen kommt.
F: Welche Funktion hat Natriumhydrosulfit bei der Reaktion mit Indigo?
A: Na2S2O4 wirkt bei der Reaktion mit Indigo als Reduktionsmittel, das den unlöslichen indigoblauen Farbstoff in eine lösliche, farblose Verbindung umwandelt.
F: Was erzeugt einen Geruch bei der Zugabe von Natriumhydrosulfit?
A: Bei der Zugabe von Na2S2O4 kann aufgrund der Freisetzung von Schwefeldioxidgas ein Schwefelgeruch entstehen.
F: Ist Natriumhydrosulfit-Dihydrat ein Reduktionsmittel?
A: Ja, Na2S2O4-Dihydrat ist ein starkes Reduktionsmittel, das häufig in industriellen Prozessen verwendet wird.
