Kaliumsulfit (K2SO3) ist eine chemische Verbindung aus Kalium, Schwefel und Sauerstoff. Es wird häufig als Konservierungsmittel in der Lebensmittelindustrie verwendet, um Verfärbungen und Verderb zu verhindern.
| IUPAC-Name | Kaliumsulfit |
| Molekularformel | K2SO3 |
| CAS-Nummer | 10117-38-1 |
| Synonyme | Dikaliumsulfit; Dikaliumsalz der schwefligen Säure; Kaliumsulfonat; Schwefel und Kaliumoxid |
| InChI | InChI=1S/2K.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Kaliumsulfit
Kaliumsulfit-Formel
Kaliumsulfit hat die chemische Formel K2SO3, was darauf hinweist, dass es zwei Kaliumatome, ein Schwefelatom und drei Sauerstoffatome enthält. Die Verbindung entsteht durch die Reaktion zwischen Kaliumhydroxid (KOH) und Schwefeldioxid (SO2). Kaliumsulfit ist eine ionische Verbindung, das heißt, es besteht aus positiv geladenen Kaliumionen und negativ geladenen Sulfitionen. Die Formel für das Sulfition lautet SO32-.
Molmasse von Kaliumsulfit
Die Molmasse von K2SO3 beträgt 158,26 g/mol. Dies wird berechnet, indem die Atommassen jedes Elements in der Formel (2 x Atommasse von K) + Atommasse von S + (3 x Atommasse von O) addiert werden. Die Molmasse einer Verbindung ist wichtig, da sie hilft, die Menge der Verbindung zu berechnen, die für eine bestimmte Reaktion benötigt wird, oder die Konzentration einer Lösung zu bestimmen.
Siedepunkt von Kaliumsulfit
K2SO3 hat keinen bestimmten Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Beim Erhitzen zersetzt sich K2SO3 jedoch thermisch unter Bildung von Kaliumsulfat (K2SO4) und Schwefeldioxid (SO2). Die Zersetzungstemperatur beträgt ca. 390°C.
Schmelzpunkt von Kaliumsulfit
Der Schmelzpunkt von K2SO3 liegt bei etwa 350°C. Bei dieser Temperatur geht die feste Verbindung in eine Flüssigkeit über. Mit steigender Temperatur zersetzt sich K2SO3 jedoch, wie bereits erwähnt.
Dichte von Kaliumsulfit g/ml
Die Dichte von K2SO3 beträgt bei Raumtemperatur 2,44 g/ml. Die Dichte ist definiert als die Masse eines Stoffes pro Volumeneinheit. Die hohe Dichte von K2SO3 weist darauf hin, dass es sich um eine relativ schwere Verbindung handelt. Diese Eigenschaft ist wichtig für die Bestimmung der physikalischen Eigenschaften der Verbindung, wie etwa ihrer Löslichkeit und Reaktivität.
Molekulargewicht von Kaliumsulfit
Das Molekulargewicht von K2SO3 beträgt 158,26 g/mol. Dieser Wert stellt die durchschnittliche Masse eines Moleküls der Verbindung dar. Das Molekulargewicht ist wichtig für die Berechnung der Menge einer Substanz in einem bestimmten Volumen oder einer bestimmten Masse, was bei chemischen Reaktionen und Laborexperimenten nützlich ist.
Struktur von Kaliumsulfit
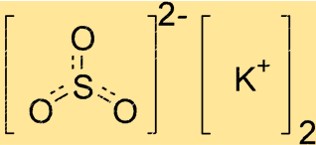
K2SO3 hat eine Kristallstruktur, das heißt, seine Atome sind in einem sich wiederholenden Muster angeordnet. Die Verbindung hat eine trigonal-planare Geometrie, mit dem Schwefelatom im Zentrum und den drei Sauerstoffatomen, die symmetrisch darum herum angeordnet sind. Außerhalb dieser Struktur befinden sich Kaliumionen, die die negative Ladung der Sulfitionen ausgleichen.
Löslichkeit von Kaliumsulfit
K2SO3 ist in Wasser gut löslich. Bei Raumtemperatur kann es sich in Wasser auflösen und eine klare, farblose Lösung bilden. Die Löslichkeit von K2SO3 beruht auf seiner ionischen Natur, die es ihm ermöglicht, in Wasser in seine Ionenbestandteile zu dissoziieren. Die Löslichkeit von K2SO3 wird auch von der Temperatur beeinflusst, wobei die Löslichkeit mit steigender Temperatur zunimmt.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 2.44 |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 158,26 g/Mol |
| Dichte | 2,44 g/ml |
| Fusionspunkt | 350°C |
| Siedepunkt | Zersetzt sich bei 390°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr gut wasserlöslich |
| Löslichkeit | Löslich in Ethanol und Glycerin |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 10.3 (für schweflige Säure) |
| pH-Wert | ~9 (für eine 0,1 M Lösung) |
Sicherheit und Gefahren von Kaliumsulfit
K2SO3 ist relativ sicher in der Handhabung und Verwendung, wenn die entsprechenden Vorsichtsmaßnahmen getroffen werden. Bei unsachgemäßer Handhabung können jedoch Gefahren entstehen. Bei Kontakt mit diesen Körperteilen kann die Verbindung Reizungen der Haut, der Augen und der Atemwege verursachen. K2SO3 kann bei Einnahme auch Magen-Darm-Probleme verursachen. Darüber hinaus stellt die Verbindung eine potenzielle Brand- und Explosionsgefahr dar, wenn sie Hitze oder Flammen ausgesetzt wird. Daher sollten bei der Arbeit mit K2SO3 entsprechende Sicherheitsmaßnahmen getroffen werden, wie z. B. das Tragen von Schutzausrüstung und die Lagerung der Verbindung fern von Hitze und Zündquellen.
| Gefahrensymbole | Totenkopf |
| Sicherheitsbeschreibung | Giftig, gesundheitsschädlich beim Verschlucken, reizt Haut und Augen |
| UN-Identifikationsnummern | UN 2697 |
| HS-Code | 283210 |
| Gefahrenklasse | 6.1 (Giftige Stoffe) |
| Verpackungsgruppe | II (mittlere Gefahr) |
| Toxizität | Oral (LD50): 345 mg/kg (Ratte) |
Methoden zur Kaliumsulfit-Synthese
K2SO3 kann durch verschiedene Methoden synthetisiert werden, einschließlich der Reaktion von Kaliumhydroxid mit Schwefeldioxid oder Schwefel, der Reaktion von Kaliumcarbonat mit Schwefeldioxid und der Reaktion von Kaliumbisulfit mit Hydroxid. Kalium.
Bei der ersten Methode reagiert eine Kaliumhydroxidlösung mit Schwefeldioxidgas in Gegenwart von Wasser unter Bildung von K2SO3. Bei der zweiten Methode wird eine Mischung aus Kaliumcarbonat und Schwefeldioxid auf hohe Temperaturen erhitzt, um K2SO3 zu erzeugen. Die dritte Methode besteht darin, Kaliumbisulfit mit Kaliumhydroxid zu mischen, um K2SO3 und Wasser zu erzeugen.
Eine weitere übliche Methode zur Synthese von K2SO3 ist die Reaktion von Schwefeldioxid mit einem Kaliumsalz wie Kaliumchlorid in Gegenwart von Reduktionsmitteln wie Natriumhydrosulfit oder Eisen(II)sulfat. Diese Methode wird häufig in industriellen Umgebungen zur Herstellung großer Mengen K2SO3 eingesetzt.
Verwendung von Kaliumsulfit
Aufgrund seiner chemischen Eigenschaften findet K2SO3 zahlreiche Anwendungen in verschiedenen Branchen. Hier sind einige häufige Verwendungen von K2SO3:
- Lebensmittel- und Getränkeindustrie: Wird als Lebensmittelkonservierungsmittel verwendet, um den Verderb und die Verfärbung von Lebensmitteln wie Wein, Trockenfrüchten und Garnelen zu verhindern.
- Fotografie: Wird als fotografisches Fixiermittel verwendet, um eine weitere Entwicklung des Films zu verhindern und das Bild dauerhaft zu machen.
- Wasseraufbereitung: Wird als Reduktionsmittel zur Entfernung von Chlor aus Wasser und zur Abwasserbehandlung verwendet.
- Papierindustrie: Wird als Bleichmittel verwendet, um Verunreinigungen zu entfernen und Zellstoff im Papierherstellungsprozess aufzuhellen.
- Textilindustrie: Wird als Reduktionsmittel verwendet, um überschüssige Farbstoffe aus Stoffen zu entfernen und Textilien aufzuhellen.
- Chemische Industrie: Wird als Reduktionsmittel bei chemischen Reaktionen verwendet, um Oxidationsmittel in Reduktionsmittel umzuwandeln.
- Medizinische Industrie: Wird bei einigen medizinischen Behandlungen verwendet, um Symptome bestimmter Erkrankungen zu verhindern oder zu lindern.
Fragen:
F: Wie lautet die Formel für Kaliumsulfit?
A: Die Formel für Kaliumsulfit lautet K2SO3.
F: Ist Kaliumsulfat ein Sulfit?
A: Nein, Kaliumsulfat ist kein Sulfit. Es ist ein Salz aus Kalium, Schwefel und Sauerstoff mit der chemischen Formel K2SO4.
F: Welches Salz entsteht, wenn H2SO4 mit NaOH reagiert? K2SO3, Na2SO4, Na2SO3, K2SO4
A: Wenn H2SO4 mit NaOH reagiert, entsteht als Salz Na2SO4.
F: Wie viele SO32-Ionen sind in 99,6 mg Na2SO3 enthalten?
Die Molmasse von Na2SO3 beträgt 126,05 g/mol. A: Um die Anzahl der SO32-Ionen zu berechnen, müssen wir zunächst die Anzahl der Mol Na2SO3 ermitteln: 99,6 mg / 126,05 g/mol = 0,000789 mol. Da Na2SO3 zwei SO32-Ionen pro Molekül enthält, beträgt die Anzahl der SO32-Ionen in 0,000789 Mol Na2SO3 0,000789 Mol x 2 = 0,00158 Mol. Daher sind in 99,6 mg Na2SO3 0,00158 mol x 6,022 x 10^23 Ionen/mol = 9,52 x 10^20 SO32-Ionen enthalten.
F: Wie viele Natriumionen sind in 99,6 mg Na2SO3 enthalten? Die Molmasse von Na2SO3 beträgt 126,05 g/mol.
A: Um die Anzahl der Natriumionen zu berechnen, müssen wir zunächst die Anzahl der Mol Na2SO3 ermitteln: 99,6 mg / 126,05 g/mol = 0,000789 mol. Da jedes Na2SO3-Molekül zwei Natriumionen enthält, beträgt die Anzahl der Natriumionen in 0,000789 Mol Na2SO3 0,000789 Mol x 2 = 0,00158 Mol. Daher sind in 99,6 mg Na2SO3 0,00158 mol x 6,022 x 10^23 Ionen/mol = 9,52 x 10^20 Natriumionen enthalten.
F: Wie lautet der chemische Name für Na2SO3?
A: Der chemische Name für Na2SO3 ist Natriumsulfit.
F: Wie heißt die Verbindung mit der Formel Na2SO3?
A: Der Name der Verbindung mit der Formel Na2SO3 ist Natriumsulfit.
