Magnesiumsulfit (MgSO3) ist eine Verbindung aus Magnesium und Sulfitionen. Es wird häufig als Lebensmittelkonservierungsmittel und Antioxidans in der Lebensmittelindustrie verwendet.
| IUPAC-Name | Magnesiumsulfit |
| Molekularformel | MgSO3 |
| CAS-Nummer | 7757-88-2 |
| Synonyme | Magnesiumsulfonat, Magnesiumschwefeltrioxid, E-536 |
| InChI | InChI=1S/Mg.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Eigenschaften von Magnesiumsulfit
Magnesiumsulfit-Formel
Magnesiumsulfit hat die chemische Formel MgSO3, was darauf hinweist, dass es aus einem Magnesiumatom, einem Schwefelatom und drei Sauerstoffatomen besteht. Das Sulfition ist ein mehratomiges Ion mit der Formel SO3 2-, bestehend aus einem zentralen Schwefelatom, das an drei Sauerstoffatome gebunden ist. Das Mg-Ion hat eine Ladung von +2, während das SO3 2–Ion eine Ladung von -2 hat, was die Verbindung elektrisch neutral macht.
Molmasse von Magnesiumsulfit
Die Molmasse von MgSO3 beträgt 104,37 g/mol, was der Summe der Atommassen eines Magnesiumatoms, eines Schwefelatoms und dreier Sauerstoffatome entspricht. Dieser Wert ist wichtig für die Berechnung der Menge an MgSO3, die für eine bestimmte Reaktion erforderlich ist, sowie für die Bestimmung der Stöchiometrie chemischer Gleichungen.
Siedepunkt von Magnesiumsulfit
MgSO3 zersetzt sich, bevor es seinen Siedepunkt erreicht, daher hat es keinen bestimmten Siedepunkt. Stattdessen beginnt es bei Temperaturen über 700 °C in Magnesiumoxid und Schwefeldioxid zu zerfallen. Dieser Zersetzungsprozess kann durch Einwirkung von Luft oder Feuchtigkeit beschleunigt werden, was MgSO3 zu einer relativ instabilen Verbindung macht.
Schmelzpunkt von Magnesiumsulfit
Der Schmelzpunkt von MgSO3 liegt bei etwa 150 °C. Bei dieser Temperatur beginnt die Verbindung in Magnesiumoxid und Schwefeldioxid zu zerfallen. Der Zersetzungsprozess ist exotherm, das heißt, es wird Wärme freigesetzt. Der Schmelzpunkt von MgSO3 ist wichtig für das Verständnis seiner Eigenschaften als Feststoff, wie etwa seiner Löslichkeit und Kristallstruktur.
Dichte von Magnesiumsulfit g/ml
Die Dichte von MgSO3 variiert je nach physikalischer Form, liegt jedoch im Allgemeinen zwischen 2,5 und 3,0 g/ml. Dieser Wert ist wichtig für die Bestimmung der Masse eines bestimmten MgSO3-Volumens sowie für das Verständnis seines Verhaltens in Lösung. Die Dichte von MgSO3 kann auch zur Berechnung seiner Dichte verwendet werden, die ein Maß für seine relative Dichte im Vergleich zu Wasser ist.
Molekulargewicht von Magnesiumsulfit
Das Molekulargewicht von MgSO3 beträgt 104,37 g/mol. Dieser Wert ist wichtig für das Verständnis der physikalischen und chemischen Eigenschaften der Verbindung sowie für die Berechnung der Menge an MgSO3, die für eine bestimmte Reaktion erforderlich ist. Das Molekulargewicht von MgSO3 kann durch Addition der Atomgewichte eines Magnesiumatoms, eines Schwefelatoms und dreier Sauerstoffatome berechnet werden.
Struktur von Magnesiumsulfit
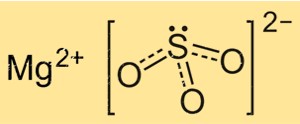
Die Struktur von MgSO3 basiert auf einem Kristallgitter aus Mg+2-Ionen und SO3 2–Ionen. Die Mg+2-Ionen sind von sechs oktaedrisch angeordneten Sauerstoffatomen umgeben, während die SO3 2–Ionen über zwei Sauerstoffatome mit den Magnesiumionen verbunden sind. Die Kristallstruktur von MgSO3 ist wichtig für das Verständnis seiner physikalischen und chemischen Eigenschaften, wie etwa seiner Löslichkeit und Reaktivität.
Löslichkeit von Magnesiumsulfit
MgSO3 ist in Wasser schlecht löslich und beträgt bei Raumtemperatur etwa 7,5 g/L. Diese geringe Löslichkeit ist auf die Kristallstruktur der Verbindung zurückzuführen, die es Wassermolekülen erschwert, in den Feststoff einzudringen und sich darin aufzulösen. MgSO3 ist in sauren Lösungen löslicher, da die Säure mit dem Sulfition unter Bildung von Bisulfit und schwefliger Säure reagieren kann. Die Löslichkeit von MgSO3 ist wichtig für das Verständnis seines Verhaltens in Lösung sowie für die Bestimmung seiner Wirksamkeit als Lebensmittelkonservierungsmittel und Antioxidans.
| Aussehen | Weißes Pulver oder Kristalle |
| Spezifisches Gewicht | 2,5 – 3,0 |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 104,37 g/Mol |
| Dichte | 2,5 bis 3,0 g/ml |
| Fusionspunkt | Etwa 150°C |
| Siedepunkt | Zersetzt sich oberhalb von 700 °C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Schwer löslich, etwa 7,5 g/L bei Raumtemperatur |
| Löslichkeit | Löslicher in sauren Lösungen |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Magnesiumsulfit
MgSO3 gilt nicht als sehr gefährlicher Stoff. Allerdings kann es bei Kontakt oder Einatmen zu Reizungen der Augen, der Haut und der Atemwege kommen. Die Einnahme von MgSO3 kann zu Magen-Darm-Reizungen und möglicherweise Erbrechen führen. Eine längere Exposition gegenüber hohen Konzentrationen kann zu Lungenschäden oder Reizungen der Atemwege führen. Daher ist es wichtig, vorsichtig mit MgSO3 umzugehen, geeignete persönliche Schutzausrüstung zu tragen und das Einatmen von Staub oder Dämpfen zu vermeiden. MgSO3 sollte an einem kühlen, trockenen und gut belüfteten Ort fern von inkompatiblen Materialien wie starken Oxidationsmitteln, Säuren und Basen gelagert werden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Vermeiden Sie das Einatmen von Staub oder Dämpfen. Tragen Sie geeignete persönliche Schutzausrüstung. |
| UN-Identifikationsnummern | Nicht reguliert |
| HS-Code | 2833.29 |
| Gefahrenklasse | Nicht als gefährlich eingestuft |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität, kann bei Kontakt oder Einatmen Reizungen der Augen, der Haut und der Atemwege verursachen. Das Verschlucken kann zu Magen-Darm-Reizungen und möglicherweise Erbrechen führen. Eine längere Exposition gegenüber hohen Konzentrationen kann zu Lungenschäden oder Reizungen der Atemwege führen. |
Synthesemethoden für Magnesiumsulfit
MgSO3 kann durch verschiedene Methoden synthetisiert werden, beispielsweise durch die Reaktion von schwefliger Säure oder Schwefeldioxidgas mit Magnesiumoxid oder Magnesiumhydroxid.
Bei einer Methode entsteht durch die Reaktion von Magnesiumoxid mit Wasser Magnesiumhydroxid , das dann mit schwefliger Säure zu MgSO3 reagiert.
Eine andere Methode beinhaltet die Reaktion von Magnesiumhydroxid mit Schwefeldioxidgas in Gegenwart von Wasser zur Bildung von MgSO3.
Bei einer anderen Methode kann durch Reaktion von Magnesiumsulfat mit Natriumsulfit oder Kaliumsulfit MgSO3 synthetisiert werden. Bei dieser Reaktion entsteht ein Niederschlag von MgSO3, den Forscher durch Filtration und Trocknung isolieren können.
Durch die Reaktion von Magnesiumacetat mit Schwefeldioxidgas in Gegenwart von Wasser kann MgSO3 hergestellt werden. Dann waschen und trocknen Sie den resultierenden MgSO3-Niederschlag.
Mit diesen Methoden kann MgSO3 für eine Vielzahl von Anwendungen hergestellt werden, darunter die Papier- und Zellstoffproduktion, die Lebensmittel- und Getränkeverarbeitung sowie die Wasseraufbereitung.
Verwendung von Magnesiumsulfit
MgSO3 wird in unterschiedlichen Branchen vielfältig eingesetzt. Hier sind einige seiner häufigsten Verwendungszwecke:
- Wasseraufbereitung: Wird als Sauerstofffänger bei der Kesselwasseraufbereitung verwendet, um Korrosion und Kesselsteinbildung zu verhindern.
- Lebensmittel- und Getränkeverarbeitung: Wird als Konservierungsmittel und Antioxidans bei der Lebensmittel- und Getränkeverarbeitung verwendet, um die Haltbarkeit zu verlängern und den Verderb zu verhindern.
- Zellstoff- und Papierproduktion: Wird in der Zellstoff- und Papierindustrie als Bleichmittel verwendet, um den Glanz und die Farbe von Papierprodukten zu verbessern.
- Textilherstellung: Wird als Reduktionsmittel bei der Textilherstellung verwendet, um überschüssigen Sauerstoff zu entfernen und die Qualität des Endprodukts zu verbessern.
- Landwirtschaft: Wird als Blattspray zur Verbesserung des Pflanzenwachstums und zur Steigerung der Ernteerträge verwendet.
- Medizin: Wird in der traditionellen Medizin wegen seiner antioxidativen und entzündungshemmenden Eigenschaften verwendet.
- Kosmetik: Wird in der Kosmetik als Emulgator, Stabilisator und pH-Regler verwendet.
- Weitere Verwendungszwecke: Wird auch bei der Herstellung von Klebstoffen, Farben und Beschichtungen sowie bei der Abwasseraufbereitung eingesetzt.
Fragen:
F: Wie lautet die Formel für Magnesiumsulfit?
A: Die Formel für Magnesiumsulfit lautet MgSO3.
F: Wie viel Magnesiumsulfit ist in einer 2,4-Mol-Probe enthalten?
A: In einer Probe von 2,4 Mol MgSO3 sind 2,4 Mol MgSO3 enthalten.
F: Wie hoch ist der Massenanteil jedes Elements in 1 Mol Magnesiumsulfit?
A: In einem Mol Magnesiumsulfit beträgt der Massenanteil an Magnesium 32,44 %, Schwefel 29,44 % und Sauerstoff 38,12 %.
F: Stoppt Magnesiumsulfit Muskelkrämpfe?
A: Es gibt keine wissenschaftlichen Beweise dafür, dass MgSO3 Muskelkrämpfe stoppen kann. Zu diesem Zweck wurde jedoch Magnesiumsulfat (Bittersalz) verwendet.
F: Welche Auswirkung hat die Zugabe von Magnesiumsulfit zu den Reaktionen?
A: Die Zugabe von MgSO3 kann bei bestimmten Reaktionen als Reduktionsmittel wirken, indem es Sauerstoff entfernt. In bestimmten Anwendungen kann es auch als Konservierungsmittel und Antioxidans wirken.
F: Ist Magnesiumsulfit ionisch oder molekular?
A: MgSO3 ist eine ionische Verbindung.
