Calciumsulfit (CaSO3) ist eine Verbindung, die Ca2+- und SO32-Ionen enthält. Aufgrund seiner Fähigkeit, Verunreinigungen zu entfernen und Verderb zu verhindern, wird es häufig als Lebensmittelkonservierungsmittel, Antioxidans und Wasserreiniger verwendet.
| IUPAC-Name | Calciumsulfit |
| Molekularformel | CaSO3 |
| CAS-Nummer | 10257-55-3 |
| Synonyme | Calciumsulfit; Schwefelige Säure, Calciumsalz; Calciumschweflige Säure; Calciumschweflige Säure; E226 |
| InChI | InChI=1S/Ca.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Eigenschaften von Calciumsulfit
Calciumsulfit-Formel
Die chemische Formel für Calciumsulfit lautet CaSO3. Diese Verbindung besteht aus einem Ca2+-Ion und einem SO32–Ion. Calciumsulfit kann durch Reaktion von Calciumhydroxid mit schwefliger Säure hergestellt werden. Es wird in der Lebensmittelindustrie häufig als Konservierungsmittel und Antioxidans sowie als Wasserreiniger verwendet.
Molmasse von Calciumsulfit
Die Molmasse von CaSO3 beträgt 120,14 g/mol. Dies kann durch Addition der Atommassen von Calcium (40,08 g/mol), Schwefel (32,06 g/mol) und drei Sauerstoffatomen (jeweils 16,00 g/mol) berechnet werden.
Siedepunkt von Calciumsulfit
CaSO3 hat keinen genau definierten Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Es kann jedoch auf eine Temperatur von etwa 450 °C erhitzt werden, bevor es zur Zersetzung kommt. Dies liegt daran, dass CaSO3 eine instabile Verbindung ist und beim Erhitzen dazu neigt, sich in Calciumsulfat und Schwefeldioxid zu zersetzen.
Schmelzpunkt von Calciumsulfit
Der Schmelzpunkt von CaSO3 liegt bei etwa 1520 °C. Dies ist die Temperatur, bei der die feste Verbindung in den flüssigen Zustand übergeht. CaSO3 hat eine kristalline Struktur und schmilzt aufgrund der starken Ionenbindungen zwischen Calcium- und Sulfitionen bei hohen Temperaturen.
Dichte von Calciumsulfit g/ml
Die Dichte von CaSO3 beträgt etwa 2,71 g/ml. Das bedeutet, dass ein Milliliter CaSO3 eine Masse von 2,71 Gramm hat. Die hohe Dichte von CaSO3 ist auf das Vorhandensein des Calciumions zurückzuführen, das eine hohe Atommasse aufweist.
Molekulargewicht von Calciumsulfit
Das Molekulargewicht von CaSO3 beträgt 120,14 g/mol. Dies lässt sich berechnen, indem man die Atomgewichte von Calcium, Schwefel und drei Sauerstoffatomen in der Verbindung addiert. Das Molekulargewicht von CaSO3 ist wichtig für die Bestimmung seiner physikalischen und chemischen Eigenschaften.
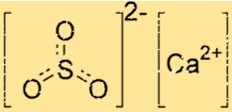
Struktur von Calciumsulfit
Die Struktur von CaSO3 besteht aus einem Ca2+-Ion und einem SO32–Ion. Das Calciumion ist von sechs Sauerstoffatomen umgeben, während das Sulfition aus zwei Sauerstoffatomen und einem Schwefelatom besteht. Das Ca2+-Ion und das SO32–Ion werden durch Ionenbindungen zusammengehalten, bei denen es sich um starke elektrostatische Anziehungskräfte zwischen entgegengesetzt geladenen Ionen handelt.
Löslichkeit von Calciumsulfit
CaSO3 ist in Wasser schlecht löslich, mit einer Löslichkeit von etwa 0,17 g/100 ml bei Raumtemperatur. Das bedeutet, dass sich nur eine kleine Menge CaSO3 in Wasser lösen kann und die restlichen Feststoffpartikel im Wasser schweben bleiben. Die Löslichkeit von CaSO3 wird durch Faktoren wie Temperatur, pH-Wert und die Anwesenheit anderer Ionen beeinflusst.
| Aussehen | Weißes Pulver oder kristalliner Feststoff |
| Spezifisches Gewicht | 2,71 |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 120,14 g/Mol |
| Dichte | 2,71 g/ml |
| Fusionspunkt | 1520°C |
| Siedepunkt | Zersetzt sich vor Erreichen des Siedepunkts |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Leicht löslich, ca. 0,17 g/100 ml bei Raumtemperatur. |
| Löslichkeit | Unlöslich in Alkohol und Ether |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 1,91 |
| pH-Wert | Leicht basisch (pH 8-9 beim Auflösen in Wasser) |
Sicherheit und Gefahren von Calciumsulfit
CaSO3 gilt allgemein als sicher für den Einsatz in der Lebensmittel- und Wasseraufbereitung. Allerdings kann es, wie jede Chemikalie, gewisse Gefahren bergen, wenn es nicht richtig gehandhabt wird. CaSO3 ist haut- und augenreizend und kann beim Einatmen zu Reizungen der Atemwege führen. Die Einnahme großer Mengen CaSO3 kann Übelkeit, Erbrechen und Durchfall verursachen. Beim Umgang mit CaSO3 sollten entsprechende Sicherheitsvorkehrungen getroffen werden, wie zum Beispiel das Tragen von Handschuhen und einer Schutzbrille. Bei Kontakt mit CaSO3 auf der Haut oder den Augen oder bei Verschlucken sollte sofort ein Arzt aufgesucht werden. Es ist auch wichtig, die richtigen Lagerungs- und Entsorgungsverfahren für CaSO3 einzuhalten, um potenzielle Gefahren zu minimieren.
| Gefahrensymbole | Keine zugewiesen |
| Sicherheitsbeschreibung | Kontakt mit Augen, Haut und Kleidung vermeiden. Tragen Sie bei der Handhabung Schutzhandschuhe und eine Schutzbrille. Bei Kontakt betroffene Stellen mit Wasser abspülen. Bei Verschlucken sofort einen Arzt aufsuchen. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 283210 |
| Gefahrenklasse | Nicht als gefährlich eingestuft |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Calciumsulfit gilt in niedrigen Konzentrationen als ungiftig, kann jedoch in hohen Dosen Magen-Darm-Reizungen und andere gesundheitliche Auswirkungen verursachen. |
Methoden zur Calciumsulfit-Synthese
Durch die Reaktion von schwefliger Säure mit Calciumhydroxid kann CaSO3 synthetisiert werden. Bei der Reaktion entstehen CaSO3 und Wasser als Nebenprodukte.
Eine andere Methode besteht darin , Calciumcarbonat mit schwefliger Säure zu reagieren, wodurch CaSO3, Wasser und Kohlendioxid entstehen. Normalerweise führen Chemiker die Reaktion in einer wässrigen Lösung bei Raumtemperatur oder etwas höher durch.
Bei einer anderen Methode entsteht durch die Reaktion von Calciumoxid mit Schwefeldioxid und die anschließende Zugabe von Wasser zum resultierenden Produkt CaSO3.
In industriellen Umgebungen entsteht bei der Absorption von Schwefeldioxid in einer Calciumhydroxidsuspension im Allgemeinen CaSO3. Bei diesem Prozess entsteht eine Mischung aus CaSO3 und Calciumsulfat, die durch Filtration oder andere Methoden getrennt werden kann. Das resultierende CaSO3 kann in einer Vielzahl von Anwendungen verwendet werden, einschließlich der Wasseraufbereitung und als Lebensmittelkonservierungsmittel.
Insgesamt gibt es mehrere Methoden zur Synthese von CaSO3, jede mit ihren eigenen Vorteilen und Einschränkungen, abhängig von der spezifischen Anwendung und der gewünschten Reinheit des Endprodukts.
Verwendung von Calciumsulfit
Aufgrund seiner einzigartigen Eigenschaften findet CaSO3 vielfältige Verwendungsmöglichkeiten in verschiedenen Branchen. Zu den häufigsten Anwendungen von CaSO3 gehören:
- Wasseraufbereitung: Wird häufig als Wasseraufbereitungsmittel zur Entfernung von Verunreinigungen und zur Desinfektion von Wasser verwendet. Es kann Chlor, Schwermetalle und andere Verunreinigungen effektiv aus dem Wasser entfernen.
- Lebensmittelkonservierung: Wird als Lebensmittelkonservierungsmittel verwendet, um den Verderb zu verhindern und die Haltbarkeit von Lebensmitteln zu verlängern. Wird häufig bei der Herstellung von Konserven und Flaschennahrungsmitteln sowie bei der Herstellung von Wein und Bier verwendet.
- Chemische Industrie: Wird in der chemischen Industrie als Reduktionsmittel und bei der Herstellung von Schwefelsäure verwendet.
- Bauwesen: Wird als Bestandteil von Baumaterialien wie Trockenbau und Zement verwendet.
- Agrarindustrie: Wird in der Landwirtschaft zur Bodenbehandlung und zur Vorbeugung von Pflanzenkrankheiten eingesetzt.
- Medizinische Anwendungen: Wird auch in medizinischen Anwendungen als Antioxidans und zur Behandlung bestimmter Erkrankungen verwendet.
Fragen:
F: Wie lautet die Formel für Calciumsulfit?
A: Die Formel für Calciumsulfit lautet CaSO3.
F: Wie ist der Zustand von Calciumsulfit?
A: CaSO3 ist bei Raumtemperatur ein Feststoff.
F: Wie viele Gramm Kalzium sind in 3,36 Gramm CaSO3 enthalten?
A: In 3,36 Gramm CaSO3 sind etwa 1,14 Gramm Kalzium enthalten.
F: Was passiert, wenn man Salzsäure und Natriumsulfit Calciumcarbonat hinzufügt?
A: Wenn Calciumcarbonat zu Salzsäure und Natriumsulfit hinzugefügt wird, kommt es zu einer Reaktion, bei der CaSO3, Wasser, Kohlendioxid und Natriumchlorid entstehen.
F: Löst sich Calciumsulfit in Wasser auf?
A: Ja, CaSO3 ist in Wasser schwer löslich.
F: Enthält das Stadtwasser Kalziumsulfit?
A: CaSO3 kommt normalerweise nicht in Stadtwasser vor, kann aber in Wasseraufbereitungsprozessen zur Entfernung von Verunreinigungen verwendet werden.
F: Kann CaSO3 aus dem Trinkwasser entfernt werden?
A: Ja, CaSO3 kann durch verschiedene Methoden wie Filtration, Umkehrosmose oder chemische Behandlung aus dem Trinkwasser entfernt werden.
F: Was produzieren CaSO3 und HCl?
A: Wenn CaSO3 zu Salzsäure hinzugefügt wird, kommt es zu einer Reaktion, bei der Calciumchlorid, Schwefeldioxidgas und Wasser entstehen.
