Kaliumnitrit (KNO2) ist eine chemische Verbindung, die häufig als Lebensmittelkonservierungsmittel verwendet wird. Es hemmt bekanntermaßen das Wachstum von Bakterien und verhindert den Verderb von Fleisch und anderen Lebensmitteln.
| IUPAC-Name | Kaliumnitrit |
| Molekularformel | KNO2 |
| CAS-Nummer | 7758-09-0 |
| Synonyme | Salpetrige Säure, Kaliumsalz; Salpeter(III); salpetrige Säure, Verbindung. mit Kaliumsalz (1:1); E249 |
| InChI | InChI=1S/K.NO2/c;2-1-3/q+1;-1 |
Eigenschaften von Kaliumnitrit
Kaliumnitrit-Formel
Die chemische Formel für Kaliumnitrit lautet KNO2. Es stellt die Zusammensetzung der Verbindung anhand ihrer Atombestandteile dar. Die Formel für Kaliumnitrit wird zur Berechnung seiner Molmasse und seines Molekulargewichts verwendet.
Molmasse von Kaliumnitrit
Die Molmasse von KNO2 beträgt 85,103 g/mol. Sie ergibt sich aus der Summe der Atommassen von Kalium (39,10 g/mol), Stickstoff (14,01 g/mol) und zwei Sauerstoffatomen (2 x 16,00 g/mol). Die Molmasse von KNO2 ist entscheidend für die Bestimmung, wie viel der Substanz in einer bestimmten Masse oder einem bestimmten Volumen vorhanden ist.
Siedepunkt von Kaliumnitrit
Der Siedepunkt von KNO2 liegt bei 320 °C (608 °F). Bei dieser Temperatur geht die Verbindung von der flüssigen Phase in die Gasphase über. Der Siedepunkt von KNO2 hängt von verschiedenen Faktoren wie Druck und Reinheit ab.
Schmelzpunkt von Kaliumnitrit
Der Schmelzpunkt von KNO2 beträgt 441 °C (826 °F). Bei dieser Temperatur geht die feste Verbindung in die flüssige Phase über. Der Schmelzpunkt von KNO2 ist ein entscheidender Parameter für die Eignung für verschiedene Anwendungen, beispielsweise zur Lebensmittelkonservierung und in der Medizin.
Dichte von Kaliumnitrit g/ml
Die Dichte von KNO2 beträgt bei Raumtemperatur 1,915 g/ml. Die Dichte eines Stoffes ist definiert als die Masse des Stoffes pro Volumeneinheit. Die Dichte von KNO2 spielt eine wichtige Rolle bei der Bestimmung seiner physikalischen Eigenschaften, wie etwa seiner Löslichkeit und chemischen Reaktivität.
Molekulargewicht von Kaliumnitrit
Das Molekulargewicht von KNO2 beträgt 85,103 g/mol. Es ist ein entscheidender Parameter zur Bestimmung der Stöchiometrie einer Reaktion mit KNO2. Das Molekulargewicht von KNO2 wird auch zur Bestimmung seiner physikalischen und chemischen Eigenschaften verwendet.
Struktur von Kaliumnitrit
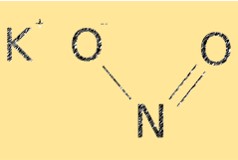
KNO2 hat die Summenformel KNO2. Es hat eine ionische Struktur mit Kaliumkationen (K+) und Nitritanionen (NO2-). Das Nitrition hat eine gekrümmte Molekülgeometrie mit einem Bindungswinkel von etwa 115°. Die Struktur von KNO2 ist für die Bestimmung seiner chemischen Eigenschaften wie Löslichkeit und Reaktivität von entscheidender Bedeutung.
Löslichkeit von Kaliumnitrit
KNO2 ist in Wasser sehr gut löslich, mit einer Löslichkeit von etwa 710 g/L bei 20 °C. Die Löslichkeit von KNO2 hängt von verschiedenen Faktoren wie Temperatur, Druck und der Anwesenheit anderer Stoffe ab. Die Löslichkeit von KNO2 ist ein entscheidender Parameter für seine Eignung für verschiedene Anwendungen, beispielsweise zur Lebensmittelkonservierung und in der Medizin.
| Aussehen | Weißer bis gelblicher kristalliner Feststoff |
| Spezifisches Gewicht | 1.915 |
| Farbe | Farblos bis weiß |
| Geruch | Geruchlos |
| Molmasse | 85,103 g/Mol |
| Dichte | 1,915 g/ml |
| Fusionspunkt | 441 °C (826 °F) |
| Siedepunkt | 320 °C (608 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr gut löslich (710 g/L bei 20°C) |
| Löslichkeit | Löslich in Ethanol, schwer löslich in Ammoniak |
| Dampfdruck | 0,0038 mmHg bei 25 °C |
| Wasserdampfdichte | 2,96 (Luft = 1) |
| pKa | 3.35 |
| pH-Wert | 5-8 (5%ige Lösung) |
Sicherheit und Gefahren von Kaliumnitrit
KNO2 kann bei unsachgemäßer Handhabung gefährlich sein. Beim Verschlucken oder Einatmen ist es gesundheitsschädlich und kann Reizungen der Augen, der Haut und der Atemwege verursachen. Eine längere oder wiederholte Exposition gegenüber KNO2 kann zu Methämoglobinämie führen, einem Zustand, der die Fähigkeit des Blutes, Sauerstoff zu transportieren, verringert. KNO2 ist außerdem ein starkes Oxidationsmittel und kann mit brennbaren Materialien heftig reagieren und einen Brand oder eine Explosion verursachen. Beim Umgang mit KNO2 sollten geeignete Sicherheitsmaßnahmen wie die Verwendung von Schutzausrüstung, ausreichende Belüftung und sichere Lagerung befolgt werden. Bei Verschlucken oder Einatmen sofort einen Arzt aufsuchen.
| Gefahrensymbole | Xn |
| Sicherheitsbeschreibung | S22, S24/25 |
| UN-Identifikationsnummern | UN 1488 |
| HS-Code | 2834.29.10 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | III |
| Toxizität | Gesundheitsschädlich bei Verschlucken oder Einatmen, kann Methämoglobinämie verursachen |
Methoden zur Kaliumnitrit-Synthese
Kaliumhydroxid (KOH) reagiert mit salpetriger Säure (HNO2) unter Bildung von KNO2. Bei der Reaktion entstehen als Nebenprodukte KNO2 und Wasser (H2O). Die Industrie nutzt dieses Verfahren häufig zur Herstellung großer Mengen KNO2.
Die Reaktionsgleichung lautet:
2 KOH + HNO2 → KNO2 + 2 H2O
Eine andere Methode zur Synthese von KNO2 ist die Reaktion von Kaliumcarbonat (K2CO3) mit Stickoxid (NO). Bei der Reaktion entstehen als Nebenprodukte KNO2, Kohlendioxid (CO2) und Stickstoff (N2). Die Gewinnung von Stickstoffmonoxid ist schwierig und teuer, weshalb diese Methode seltener eingesetzt wird.
Die Reaktionsgleichung lautet:
2 K2CO3 + 2 NO → 2 KNO2 + 2 CO2 + N2
KNO2 kann durch Oxidation von KNO3 mit einem Reduktionsmittel wie SO2 oder FeSO4 gewonnen werden.
Bei der Reaktion entstehen als Nebenprodukte KNO2, Wasser und die reduzierte Form des Reduktionsmittels. Wissenschaftler verwenden diese Methode seltener und behalten sie im Allgemeinen für Synthesen im Labor im kleinen Maßstab vor.
Die Gleichung für die Reaktion mit Schwefeldioxid lautet:
2 KNO3 + 3 SO2 + H2O → 2 KNO2 + 3 H2SO4
Verwendung von Kaliumnitrit
Aufgrund seiner chemischen Eigenschaften findet KNO2 zahlreiche Anwendungen in Industrie und Labor. Einige der häufigsten Anwendungen von KNO2 sind:
- Lebensmittelkonservierung: Wird als Konservierungsmittel in Wurstwaren verwendet, um das Wachstum schädlicher Bakterien zu verhindern und deren Haltbarkeit zu verlängern.
- Chemische Industrie: Wird als Zwischenprodukt bei der Herstellung verschiedener Chemikalien wie salpetriger Säure, Diazoniumverbindungen und organischen Nitriten verwendet.
- Landwirtschaft: Wird aufgrund seiner hohen Wasserlöslichkeit und Fähigkeit zur Stickstofffreisetzung als Dünger und Bodenverbesserer verwendet.
- Laborreagenz: Wird als Reagenz in verschiedenen Laboranwendungen verwendet, beispielsweise zum Nachweis primärer Amine und zur Herstellung von Diazoniumsalzen.
- Medizinische Verwendung: Wird zur Behandlung von Zyanidvergiftungen verwendet, da es mit Zyanidionen unter Bildung von ungiftigem Cyanmethämoglobin reagiert.
- Fotografie: Wird als Zusatzstoff in Fotoentwicklern verwendet, um die Qualität und Klarheit der entwickelten Bilder zu verbessern.
- Glasindustrie: Wird in der Glasindustrie als Bleichmittel verwendet, um unerwünschte Farbstoffe aus Glasprodukten zu entfernen.
Fragen:
Was ist Kaliumnitrit?
A: KNO2 ist eine anorganische Verbindung, die häufig in verschiedenen Industrie- und Laboranwendungen verwendet wird.
F: Wie lautet die Formel für Kaliumnitrit?
A: Die chemische Formel für Kaliumnitrit lautet KNO2.
F: Welches Salz entsteht, wenn NH4OH mit HNO3 reagiert? KNO2, NaNO3, NH4NO3 oder NH4NO2?
A: Wenn NH4OH mit HNO3 reagiert, entsteht NH4NO3 als Salz.
F: Ist KNO2 eine Säure oder eine Base?
A: KNO2 ist eine basische Verbindung.
F: Wie heißt die Verbindung mit der Formel KNO2?
A: Der Name der Verbindung mit der Formel KNO2 ist Kaliumnitrit.
F: Ist KNO2 eine schwache Base?
A: KNO2 gilt als schwache Base.
F: Ist KNO2 sauer oder basisch?
A: KNO2 ist basischer Natur und kann als mildes Reduktionsmittel wirken.
