Kaliumoxid (K2O) ist eine chemische Verbindung, die aus zwei Kaliumatomen und einem Sauerstoffatom besteht. Aufgrund seines hohen Kaliumgehalts wird es häufig in der Düngemittelproduktion verwendet.
| IUPAC-Name | Kaliumoxid |
| Molekularformel | K2O |
| CAS-Nummer | 12136-45-7 |
| Synonyme | Kali, Dikaliumoxid, Kaliummonoxid |
| InChI | InChI=1S/2K.O |
Eigenschaften von Kaliumoxid
Kaliumoxid-Formel
Die Formel für Kaliumoxid lautet K2O. Das bedeutet, dass jedes K2O-Molekül zwei K-Atome und ein O-Atom enthält. Die Formel für Kaliumoxid ist wichtig für chemische Berechnungen, beispielsweise zur Bestimmung der Molmasse und Stöchiometrie der Verbindung in chemischen Reaktionen.
Molmasse von Kaliumoxid
K2O hat eine Molmasse von 94,2 g/mol. Das bedeutet, dass ein Mol K2O 94,2 Gramm der Verbindung enthält. Die Molmasse einer Verbindung ist für viele chemische Berechnungen wichtig, beispielsweise für die Bestimmung der für eine Reaktion benötigten Menge einer Verbindung oder der Masse einer Probe der Verbindung.
Siedepunkt von Kaliumoxid
K2O hat einen hohen Siedepunkt von 3.150 °C (5.720 °F). Dieser hohe Siedepunkt ist auf die starken Ionenbindungen zwischen den Kalium- und Sauerstoffatomen der Verbindung zurückzuführen. K2O ist bei Raumtemperatur und -druck ein Feststoff, kann aber bei sehr hohen Temperaturen in ein Gas verdampfen.
Schmelzpunkt von Kaliumoxid
Der Schmelzpunkt von K2O beträgt 740 °C (1.364 °F). Das bedeutet, dass K2O bei Temperaturen über 740 °C schmilzt und flüssig wird. Der Schmelzpunkt von K2O ist im Vergleich zu anderen ionischen Verbindungen wie Natriumchlorid (801 °C) und Magnesiumoxid (2852 °C) relativ hoch.
Dichte von Kaliumoxid g/ml
Die Dichte von K2O beträgt 2,32 g/cm³. Diese Dichte ist größer als die von Wasser (1 g/cm³) und weist darauf hin, dass es sich bei K2O um eine relativ dichte Verbindung handelt. Die hohe Dichte von K2O ist auf die Nähe der Kalium- und Sauerstoffatome in der Kristallgitterstruktur der Verbindung zurückzuführen.
Molekulargewicht von Kaliumoxid
Das Molekulargewicht von K2O beträgt 94,2 g/mol. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in einem Molekül der Verbindung. Das Molekulargewicht von K2O ist wichtig für stöchiometrische Berechnungen, beispielsweise zur Bestimmung der Menge an Reaktanten, die für eine chemische Reaktion benötigt werden.
Struktur von Kaliumoxid
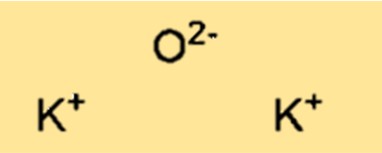
K2O hat eine Kristallgitterstruktur. Die Struktur besteht aus Kaliumkationen (K+) und Oxidanionen (O2-), die in einem dreidimensionalen, sich wiederholenden Muster angeordnet sind. Die Kristallgitterstruktur von K2O ist wichtig für die Bestimmung der physikalischen und chemischen Eigenschaften der Verbindung.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2.32 |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 94,2 g/Mol |
| Dichte | 2,32 g/cm³ |
| Fusionspunkt | 740 °C (1364 °F) |
| Siedepunkt | 3.150 °C (5.720 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert heftig mit Wasser |
| Löslichkeit | Unlöslich in organischen Lösungsmitteln |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Kaliumoxid
K2O birgt mehrere Sicherheitsrisiken und Gefahren. Es reagiert heftig mit Wasser, setzt dabei große Mengen Wärme frei und produziert Kaliumhydroxid. Diese Reaktion kann zu Verbrennungen und Bränden führen, daher ist es wichtig, vorsichtig mit K2O umzugehen. Das Einatmen oder Verschlucken von K2O kann zu Reizungen der Atemwege, Augen und Haut führen. Darüber hinaus kann die hohe Temperatur, die zum Schmelzen oder Verdampfen von K2O erforderlich ist, eine Verbrennungs- oder Brandgefahr darstellen. Daher sollte beim Umgang mit K2O geeignete Schutzausrüstung, einschließlich Handschuhe, Schutzbrille und Atemschutzmaske, getragen werden, um diese Risiken zu minimieren.
| Gefahrensymbole | Oxidierend, ätzend |
| Sicherheitsbeschreibung | Von Wasser fernhalten, nicht einatmen, Schutzausrüstung tragen |
| UN-Identifikationsnummern | UN 2257 |
| HS-Code | 2815.20 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | Ätzt die Haut und die Augen und kann beim Einatmen zu Reizungen der Atemwege führen |
Methoden zur Kaliumoxid-Synthese
Verschiedene Methoden können K2O synthetisieren.
Eine übliche Methode besteht darin , Kaliumcarbonat, K2CO3 , in Gegenwart von Sauerstoff auf hohe Temperaturen zu erhitzen. Bei diesem Prozess entstehen K2O, Kohlendioxid und Wasserdampf.
Eine andere Methode beinhaltet die Reaktion von metallischem Kalium mit Sauerstoffgas, wobei K2O entsteht und dabei eine große Wärmemenge freigesetzt wird.
Durch eine Reaktion zwischen KOH und einem Metalloxid wie Kupferoxid oder Eisenoxid kann K2O entstehen. Bei der Reaktion entstehen das entsprechende Metallhydroxid und K2O.
Kaliummetall reagiert mit Wasser unter Bildung von Kaliumhydroxid und Wasserstoffgas, was zur Synthese von K2O führt. Die Dehydratisierung von Kaliumhydroxid führt zur Bildung von K2O.
Bei chemischen Gasphasenabscheidungsverfahren führt der Hochtemperaturreaktor ein Gas ein, das Kalium und Sauerstoff enthält, um K2O zu synthetisieren. Das Gas unterliegt einer chemischen Reaktion zur Bildung von K2O, das sich auf der Substratoberfläche ablagert.
Verwendung von Kaliumoxid
Aufgrund seiner chemischen und physikalischen Eigenschaften findet K2O vielfältige Einsatzmöglichkeiten in verschiedenen Branchen. Hier sind einige häufige Anwendungen von K2O:
- Düngemittelproduktion: Ein wichtiges Element in der Düngemittelproduktion. Es hilft Pflanzen zu wachsen und ihre Gesundheit zu erhalten.
- Glasherstellung: Wird bei der Glasherstellung verwendet, um die Schmelztemperatur zu senken und die mechanische Festigkeit von Glas zu verbessern.
- Metallurgie: Wird in der Metallurgie zur Herstellung von Metallen wie Titan und Aluminium verwendet. Dadurch werden Verunreinigungen entfernt und die Gesamtqualität des Endprodukts verbessert.
- Erdölindustrie: Wird in der Erdölindustrie als Katalysator bei der Herstellung von Methanol und anderen Chemikalien verwendet.
- Batterien: Batteriehersteller verwenden K2O als Elektrolyt bei der Herstellung von Batterien, insbesondere Alkalibatterien.
- Trockenmittel: Es ist ein starkes Trockenmittel. Wird verwendet, um Feuchtigkeit aus Materialien wie Lösungsmitteln, Kraftstoffen und Gasen zu entfernen.
- Laborreagenz: Wird auch als Laborreagenz für verschiedene chemische Reaktionen und Prozesse verwendet.
Fragen:
F: Wie lautet die chemische Formel für Kaliumoxid?
A: Die chemische Formel für Kaliumoxid lautet K2O.
F: Wie lautet die Formel für Kaliumoxid?
A: Die Formel für Kaliumoxid ist K2O.
F: Ist Kaliumoxid wasserlöslich?
A: Ja, K2O ist wasserlöslich, reagiert jedoch heftig mit Wasser unter Bildung von Kaliumhydroxid.
F: Wie viele Gramm Kaliumpermanganat werden benötigt, um 2 g Toluol vollständig zu oxidieren?
A: Die Anzahl der Gramm Kaliumpermanganat, die erforderlich sind, um 2 g Toluol vollständig zu oxidieren, hängt von den Reaktionsbedingungen und der Stöchiometrie ab. Um die erforderliche Menge an Kaliumpermanganat zu bestimmen, sind eine ausgewogene Gleichung und Reaktionsbedingungen erforderlich.
F: Ist K2O ionisch oder kovalent?
A: K2O ist eine ionische Verbindung, die aus K+-Kationen und O2–Anionen besteht.
F: Was ist K2O?
A: K2O ist die chemische Formel für Kaliumoxid, eine ionische Verbindung mit vielen industriellen Anwendungen.
F: Welche Art von Bindung ist K2O?
A: Die Bindung zwischen Kalium und Sauerstoff in K2O ist ionisch.
