Kaliumsulfat (K2SO4) ist eine Verbindung, die Kalium, Schwefel und Sauerstoff enthält. Es wird häufig als Dünger verwendet, um Pflanzen mit wichtigen Nährstoffen zu versorgen und die Bodenqualität zu verbessern.
| IUPAC-Name | Kaliumsulfat |
| Molekularformel | K2SO4 |
| CAS-Nummer | 7778-80-5 |
| Synonyme | Schwefelsäure, Dikaliumsalz; Dikaliumsulfat; Arkanit; Schwefelsäure, Kaliumsalz (1:2); Kaliumsulfat; Sal polychrestum; arkanes Duplikattum |
| InChI | InChI=1S/2K.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Eigenschaften von Kaliumsulfat
Kaliumsulfat-Formel
Die chemische Formel für Kaliumsulfat lautet K2SO4. Das bedeutet, dass jedes Kaliumsulfatmolekül zwei Kaliumatome, ein Schwefelatom und vier Sauerstoffatome enthält. Die Kaliumsulfatformel eignet sich zur Bestimmung der Stöchiometrie von Reaktionen, an denen die Verbindung beteiligt ist, sowie zur Berechnung der Menge an Kaliumsulfat, die für eine bestimmte Anwendung benötigt wird.
Molmasse von Kaliumsulfat
K2SO4 hat eine Molmasse von etwa 174.259 g/mol. Dieser Wert wird berechnet, indem die Atommassen jedes Elements in der Verbindung addiert werden, also zwei Kaliumatome, ein Schwefelatom und vier Sauerstoffatome. Die Molmasse ist ein nützlicher Wert zur Bestimmung der Menge an K2SO4, die für eine bestimmte Anwendung benötigt wird, beispielsweise für die Düngemittelproduktion oder für Laborexperimente.
Siedepunkt von Kaliumsulfat
Der Siedepunkt von K2SO4 beträgt etwa 1.690 °C (3.074 °F). Dies ist die Temperatur, bei der die Verbindung von flüssig in gasförmig übergeht. Der hohe Siedepunkt von K2SO4 macht es für Anwendungen nützlich, die eine hohe Temperaturstabilität erfordern, beispielsweise bei der Herstellung von Düngemitteln und Industriechemikalien.
Schmelzpunkt von Kaliumsulfat
Der Schmelzpunkt von K2SO4 beträgt etwa 1,069 °C (1,956 °F). Dies ist die Temperatur, bei der die feste Verbindung in den flüssigen Zustand übergeht. Der relativ hohe Schmelzpunkt von K2SO4 macht es für Hochtemperaturanwendungen nützlich, beispielsweise bei der Herstellung von Glas, Keramik und Düngemitteln.
Dichte von Kaliumsulfat g/ml
Die Dichte von K2SO4 beträgt bei Raumtemperatur etwa 2,66 g/ml. Das bedeutet, dass ein Milliliter K2SO4 2,66 Gramm wiegt. Die Dichte von K2SO4 hängt von Temperatur und Druck ab und kann zur Berechnung der Masse oder des Volumens der Verbindung verwendet werden, die für eine bestimmte Anwendung benötigt wird.
Molekulargewicht von Kaliumsulfat
Das Molekulargewicht von K2SO4 beträgt 174.259 g/mol. Dieser Wert wird durch Addition der Atomgewichte aller Elemente in der Verbindung berechnet. Das Molekulargewicht ist nützlich, um die Menge an K2SO4 zu berechnen, die für bestimmte Anwendungen benötigt wird, beispielsweise in Düngemitteln oder Industriechemikalien.
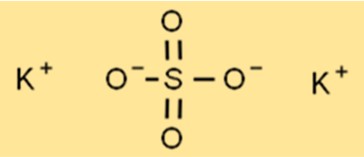
Struktur von Kaliumsulfat
Die Struktur von K2SO4 ist eine Kristallgitterstruktur, wobei jedes Kaliumion von sechs oktaedrisch geformten Sauerstoffionen umgeben ist. Das Schwefelatom befindet sich in der Mitte des Gitters, wobei jedes Schwefelatom von vier Sauerstoffionen in Tetraederform umgeben ist. Diese Gitterstruktur verleiht K2SO4 seine charakteristischen Eigenschaften, wie zum Beispiel seinen hohen Schmelz- und Siedepunkt.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2,66 bei 20°C |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 174.259 g/Mol |
| Dichte | 2,66 g/cm³ bei 20°C |
| Fusionspunkt | 1069 °C (1956 °F) |
| Siedepunkt | 1.690 °C (3.074 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 111 g/L bei 20°C |
| Löslichkeit | Löslich in Wasser, unlöslich in Ethanol |
| Dampfdruck | 0,0 mmHg bei 25°C |
| Wasserdampfdichte | Unzutreffend |
| pKa | 1.: 2,17; 2.: 7:20 Uhr; 3.: 11.8 |
| pH-Wert | 5,5–8,5 (1 %ige Lösung) |
Sicherheit und Gefahren von Kaliumsulfat
K2SO4 gilt allgemein als sicher für den Einsatz in industriellen, landwirtschaftlichen und Laborumgebungen. Allerdings kann die Verbindung bei Einnahme oder Einatmen großer Mengen Reizungen oder Schäden an Haut, Augen und Atemwegen verursachen. Darüber hinaus kann K2SO4 mit bestimmten Chemikalien, wie z. B. starken Säuren, reagieren und gefährliche Dämpfe oder Brände erzeugen. Es ist wichtig, mit K2SO4 vorsichtig umzugehen, geeignete Schutzausrüstung zu verwenden und Sicherheitshinweise zu befolgen. Die Lagerung von K2SO4 sollte an einem kühlen, trockenen und gut belüfteten Ort, entfernt von inkompatiblen Materialien, erfolgen.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | S24/25: Kontakt mit Haut und Augen vermeiden. |
| UN-Identifikationsnummern | UN 6066 |
| HS-Code | 3104.30.00 |
| Gefahrenklasse | Für den Transport ungefährlich |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität |
Methoden zur Kaliumsulfat-Synthese
Es gibt mehrere Methoden zur Synthese von K2SO4.
Eine gängige Methode ist die Reaktion von Kaliumchlorid mit Schwefelsäure . Bei der Reaktion entstehen K2SO4 und Chlorwasserstoff als Nebenprodukt.
Eine andere Methode beinhaltet die Reaktion von Kaliumhydroxid mit Schwefelsäure . Bei dieser Reaktion entstehen auch K2SO4 und Wasser als Nebenprodukt.
K2SO4 kann auch aus dem Mineral Langbeinit gewonnen werden, einem natürlichen Mineral, das K2SO4, Magnesiumsulfat und Natriumchlorid enthält. Typischerweise fördern Bergleute das Mineral und verarbeiten es, um Verunreinigungen zu entfernen und das K2SO4 abzutrennen.
Eine andere Methode zur Herstellung von K2SO4 beinhaltet die Reaktion von Kaliumcarbonat mit Schwefelsäure . Bei dieser Reaktion entstehen K2SO4 und Kohlendioxid als Nebenprodukt.
Verwendung von Kaliumsulfat
K2SO4 hat ein breites Anwendungsspektrum in verschiedenen Branchen. Hier sind einige der häufigsten Anwendungen von K2SO4:
- Dünger: Aufgrund seines hohen Kaliumgehalts ein beliebter Dünger. Wird beim Anbau von Obst, Gemüse und anderen Nutzpflanzen verwendet.
- Glasindustrie: Wird als Flussmittel bei der Glasherstellung verwendet. Dies trägt dazu bei, den Schmelzpunkt von Glas zu senken und seine Haltbarkeit zu verbessern.
- Pharmazeutische Industrie: Wird als Bestandteil verschiedener Medikamente verwendet, darunter Abführmittel und Elektrolytersatzlösungen.
- Lebensmittelindustrie: Wird als Lebensmittelzusatz zur Regulierung des Säuregehalts und als Backmittel in Backwaren verwendet.
- Industrielle Anwendungen: Wird in verschiedenen industriellen Anwendungen verwendet, einschließlich der Produktion von Aluminium, Kaliumcarbonat und anderen Chemikalien.
- Tierfutter: Wird als Nahrungsergänzungsmittel für Nutztiere und Geflügel verwendet, um ein gesundes Wachstum und eine gesunde Entwicklung zu fördern.
- Wasseraufbereitung: Wird bei der Wasseraufbereitung verwendet, um Ablagerungen und Korrosion in Kesseln und anderen Geräten zu kontrollieren.
Fragen:
F: Ist Kaliumsulfat löslich?
A: Ja, K2SO4 ist wasserlöslich. Es hat eine Löslichkeit von etwa 111 g/L bei Raumtemperatur.
F: Was entsteht als festes Produkt, wenn Strontiumbromid und Kaliumsulfat reagieren?
A: Wenn Strontiumbromid und K2SO4 reagieren, entsteht als festes Produkt Strontiumsulfat (SrSO4), ein unlöslicher weißer Feststoff.
F: Was entsteht sonst noch bei der Austauschreaktion von Silbernitrat und Kaliumsulfat?
A: Bei der Austauschreaktion von Silbernitrat und K2SO4 entstehen auch Silbersulfat (Ag2SO4) und Kaliumnitrat (KNO3).
F: Ist Kaliumsulfat eine Säure oder eine Base?
A: K2SO4 ist weder eine Säure noch eine Base, es ist ein Salz. Es entsteht durch die Neutralisationsreaktion zwischen einer Säure (Schwefelsäure) und einer Base (Kaliumhydroxid).
F: Ist k2so4 wasserlöslich?
A: Ja, K2SO4 ist wasserlöslich. Es ist sehr gut löslich und seine Löslichkeit nimmt mit der Temperatur zu.
F: Welches Salz entsteht, wenn H2SO4 mit NaOH reagiert? k2so3 na2so4 na2so3 k2so4 A: Wenn H2SO4 mit NaOH reagiert, entsteht als Salz Na2SO4 (Natriumsulfat) mit Wasser.
F: Wie viele Mol K2so4 sind in 15,0 g K2so4 enthalten?
A: Um die Anzahl der Mol K2SO4 in 15,0 g K2SO4 zu bestimmen, müssen wir die angegebene Masse durch die Molmasse von K2SO4 dividieren, die 174,259 g/mol beträgt. Die Molzahl K2SO4 in 15,0 g beträgt also 0,086 Mol.
F: Wie lautet die Formel für den Niederschlag, der sich bildet, wenn pb(no3)2 (aq) und k2so4 (aq) gemischt werden?
A: Wenn Pb(NO3)2 (wässrig) und K2SO4 (wässrig) gemischt werden, entsteht als Niederschlag PbSO4 (Bleisulfat), ein unlöslicher weißer Feststoff. Die ausgeglichene Gleichung für diese Reaktion lautet Pb(NO3)2 + K2SO4 → PbSO4 + 2KNO3.
