Trinatriumphosphat (Na3PO4) ist eine Verbindung bestehend aus Natrium- und Phosphationen. Aufgrund seiner Fähigkeit, den Säuregehalt zu kontrollieren und als Puffer zu fungieren, wird es in verschiedenen Branchen wie der Lebensmittel-, Pharma- und Waschmittelindustrie eingesetzt.
| IUPAC-Name | Trinatriumphosphat |
| Molekularformel | Na3PO4 |
| CAS-Nummer | 7601-54-9 |
| Synonyme | Natriumphosphat, TSP, Natriumorthophosphat, tribasisches Natriumphosphat, tertiäres Natriumphosphat, Trinatriumorthophosphat |
| InChI | InChI=1S/3Na.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
Eigenschaften von Trinatriumphosphat
Trinatriumphosphat-Formel
Die chemische Formel für Trinatriumphosphat lautet Na3PO4. Es besteht aus drei Natriumkationen (Na+) und einem Phosphatanion (PO43-). Die Formel ist wichtig zur Bestimmung der Stöchiometrie chemischer Reaktionen und zur Berechnung der Menge eines Stoffes in einer bestimmten Menge.
Molmasse von Trinatriumphosphat
Die Molmasse von Na3PO4 beträgt 163,94 g/mol. Sie wird durch Addition der Atommassen seiner Bestandteile Natrium, Phosphor und Sauerstoff berechnet. Die Molmasse ist ein wichtiger Parameter, um zu bestimmen, wie viel von einem Stoff in einer bestimmten Menge enthalten ist. Es wird auch zur Berechnung der Stöchiometrie chemischer Reaktionen verwendet.
Trinatriumphosphat Siedepunkt
Der Siedepunkt von Na3PO4 beträgt 1587°C. Dies ist die Temperatur, bei der der flüssige Zustand in den gasförmigen Zustand übergeht. Der Siedepunkt eines Stoffes hängt von verschiedenen Faktoren wie Druck, Temperatur und zwischenmolekularen Kräften ab. Der hohe Siedepunkt von Na3PO4 ist auf seinen ionischen Charakter und die starken intermolekularen Kräfte zurückzuführen.
Schmelzpunkt von Trinatriumphosphat
Der Schmelzpunkt von Na3PO4 beträgt 1340°C. Dies ist die Temperatur, bei der ein fester Stoff in einen flüssigen Zustand übergeht. Der Schmelzpunkt eines Stoffes hängt von verschiedenen Faktoren wie Druck, Temperatur und zwischenmolekularen Kräften ab. Der hohe Schmelzpunkt von Na3PO4 ist auf seinen ionischen Charakter und die starken intermolekularen Kräfte zurückzuführen.
Trinatriumphosphat Dichte g/ml
Die Dichte von Na3PO4 beträgt 2,54 g/ml. Die Dichte ist das Maß für die Masse eines Stoffes pro Volumeneinheit. Es handelt sich um eine wichtige physikalische Eigenschaft eines Stoffes, die zur Bestimmung seiner Masse oder seines Volumens dient. Die hohe Dichte von Na3PO4 ist auf seine ionische Natur und die dicht gepackten Partikel zurückzuführen.
Molekulargewicht von Trinatriumphosphat
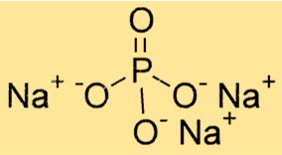
Das Molekulargewicht von Na3PO4 beträgt 163,94 g/mol. Es ist die Summe der Atomgewichte aller Atome in einem Molekül. Das Molekulargewicht von Na3PO4 ist wichtig für die Bestimmung der Stöchiometrie chemischer Reaktionen und für die Berechnung der Menge einer Substanz in einer bestimmten Menge.
Struktur von Trinatriumphosphat
Na3PO4 hat eine Kristallstruktur mit einer hexagonalen Anordnung dicht gepackter Atome. Natriumkationen befinden sich in den Zwischenräumen kompakter Sauerstoffanionen. Das Phosphatanion besteht aus einem Phosphoratom und vier Sauerstoffatomen, die tetraedrisch angeordnet sind.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | 2.536 g/cm3 |
| Farbe | Farblos bis weiß |
| Geruch | Geruchlos |
| Molmasse | 163,94 g/Mol |
| Dichte | 2,54 g/ml |
| Fusionspunkt | 1340°C |
| Siedepunkt | 1.587°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Wasser und unlöslich in organischen Lösungsmitteln |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | pKa1 = 2,15, pKa2 = 7,20, pKa3 = 12,35 |
| pH-Wert | pH-Wert einer 0,1 M Lösung = 11,5 |
Sicherheit und Gefahren von Trinatriumphosphat
Na3PO4 gilt allgemein als sicher für die Verwendung in Lebensmitteln, Arzneimitteln und anderen Anwendungen. Allerdings kann es, wie jede Chemikalie, bei unsachgemäßer Handhabung Gefahren bergen. Die Einnahme großer Mengen Na3PO4 kann zu Magen-Darm-Problemen wie Durchfall, Übelkeit und Erbrechen führen. Augen- und Hautkontakt mit der Substanz können zu Reizungen und Verbrennungen führen. Bei der Arbeit mit diesem Stoff ist es wichtig, vorsichtig mit Na3PO4 umzugehen, geeignete persönliche Schutzausrüstung zu tragen und alle Sicherheitsmaßnahmen zu befolgen. Bei Verschlucken oder versehentlicher Exposition sofort einen Arzt aufsuchen.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Bei ausreichender Belüftung verwenden. Kontakt mit Haut und Augen vermeiden. Schutzausrüstung tragen. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 28352200 |
| Gefahrenklasse | Nicht als gefährlich eingestuft |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität. Die Einnahme großer Mengen kann zu Magen-Darm-Problemen führen. Kann bei Haut- und Augenkontakt zu Reizungen und Verbrennungen führen. |
Methoden zur Synthese von Trinatriumphosphat
Es gibt verschiedene Methoden zur Synthese von Na3PO4, darunter die Reaktion von Natriumhydroxid mit Phosphorsäure , die Reaktion von Natriumcarbonat mit Phosphorsäure und die Reaktion von Natriumchlorid mit Phosphorsäure in Gegenwart von Natriumcarbonat.
Eine übliche Methode beinhaltet die Reaktion von Natriumhydroxid (NaOH) mit Phosphorsäure (H3PO4) . Bei dieser Reaktion entstehen Na3PO4 (Na3PO4) und Wasser (H2O). Die ausgewogene chemische Gleichung für diese Reaktion lautet:
3 NaOH + H3PO4 → Na3PO4 + 3 H2O
Eine andere Methode beinhaltet die Reaktion von Natriumcarbonat (Na2CO3) mit Phosphorsäure (H3PO4) . Bei dieser Reaktion entstehen Na3PO4 (Na3PO4), Kohlendioxid (CO2) und Wasser (H2O). Die ausgewogene chemische Gleichung für diese Reaktion lautet:
Na2CO3 + 2 H3PO4 → 2 Na3PO4 + 3 CO2 + 3 H2O
Eine dritte Methode beinhaltet die Reaktion von Natriumchlorid (NaCl) mit Phosphorsäure (H3PO4) in Gegenwart von Natriumcarbonat (Na2CO3) . Bei dieser Reaktion entstehen Na3PO4 (Na3PO4), Natriumchlorid (NaCl), Kohlendioxid (CO2) und Wasser (H2O). Die ausgewogene chemische Gleichung für diese Reaktion lautet:
3 NaCl + H3PO4 + Na2CO3 → Na3PO4 + 3 NaCl + 3 CO2 + 3 H2O
Die Industrie nutzt diese Methoden häufig zur Herstellung von Na3PO4 für verschiedene Anwendungen.
Verwendung von Trinatriumphosphat
Aufgrund seiner einzigartigen Eigenschaften findet Na3PO4 vielfältige Einsatzmöglichkeiten in verschiedenen Branchen. Einige häufige Anwendungen von Na3PO4 sind:
- Lebensmittelindustrie: Wird als Lebensmittelzusatzstoff verwendet, um die Textur, den Geschmack und die Haltbarkeit verarbeiteter Lebensmittelprodukte zu verbessern.
- Pharmazeutische Industrie: Wird bei der Herstellung verschiedener pharmazeutischer Produkte verwendet, darunter Abführmittel, Antazida und Elektrolytlösungen.
- Wasseraufbereitung: Wird in Wasseraufbereitungsprozessen verwendet, um die Bildung von Ablagerungen zu kontrollieren und Korrosion in Wasserverteilungssystemen zu verhindern.
- Waschmittelindustrie: Wird bei der Herstellung von Waschmitteln verwendet, um deren Reinigungseigenschaften zu verbessern.
- Landwirtschaft: Wird in der Landwirtschaft als Dünger und Bodenverbesserer verwendet, um Pflanzen mit wichtigen Nährstoffen zu versorgen.
- Industrielle Anwendungen: Wird in verschiedenen industriellen Prozessen verwendet, einschließlich der Metalloberflächenbehandlung, der Keramikproduktion und als Flammschutzmittel.
- Laboranwendungen: Wird in verschiedenen Laboranwendungen verwendet, einschließlich DNA- und Proteinreinigung, Pufferlösungen und als pH-Regulator.
Fragen:
F: Ist Na3PO4 wasserlöslich?
A: Ja, Na3PO4 ist in Wasser gut löslich.
F: Wie hoch ist die molare Konzentration von Natriumionen in einer 0,350 M Na3PO4-Lösung?
A: In einer 0,350 M Na3PO4-Lösung beträgt die molare Konzentration an Natriumionen 1,05 M.
F: Ist Na3PO4 eine Säure oder eine Base?
A: Na3PO4 ist ein basisches Salz.
F: Wie lautet die Nettoionengleichung für die Reaktion zwischen wässrigen Lösungen von Na3PO4 und CuSO4?
A: Die Nettoionengleichung für die Reaktion zwischen wässrigen Lösungen von Na3PO4 und CuSO4 lautet: 2Na+(aq) + Cu2+(aq) + 2PO43-(aq) + SO42-(aq) → Cu3(PO4)2(s) + 2Na+ (aq) + SO42-(aq).
F: Welches Volumen einer 3,50 M Na3PO4-Lösung sollten Sie verwenden, um 1,50 l einer 2,55 M Na3PO4-Lösung herzustellen?
A: Um eine 2,55 M Na3PO4-Lösung mit einer 3,50 M Na3PO4-Lösung herzustellen, müssen Sie 0,921 l der 3,50 M Lösung verwenden.
F: Was ist Trinatriumphosphat?
A: Trinatriumphosphat ist ein anorganisches Natriumphosphatsalz mit der chemischen Formel Na3PO4.
F: Ist Trinatriumphosphat löslich?
A: Ja, Trinatriumphosphat ist gut wasserlöslich.
F: Woher wissen Sie, ob es sich bei dem weißen Pulver, das Sie haben, um Natriumbicarbonat oder Trinatriumphosphat handelt?
A: Eine Möglichkeit, Natriumbicarbonat von Na3PO4 zu unterscheiden, ist die Durchführung eines einfachen pH-Tests. Natriumbicarbonat ist basisch und ergibt einen pH-Wert über 7, während Na3PO4 neutral ist und einen pH-Wert von 7 ergibt.
F: Wie lautet die Formel für Trinatriumphosphat?
A: Die Formel für Trinatriumphosphat lautet Na3PO4.
