Kaliumiodid (KI) ist eine chemische Verbindung, die die Aufnahme von radioaktivem Jod durch die Schilddrüse verhindert. Es ist wirksam, wenn es vor oder kurz nach der Exposition gegenüber radioaktivem Jod eingenommen wird.
| Name der IUPAC | Kaliumiodid |
| Molekularformel | KI |
| CAS-Nummer | 7681-11-0 |
| Synonyme | Kaliumiodid, Kaliummonoiodid, K-Iodid, KI |
| InChI | InChI=1S/HI.K/h1H;/q;+1/p-1 |
Eigenschaften von Kaliumiodid
Kaliumjodid-Formel
Die Formel für Kaliumiodid lautet KI. Diese Formel stellt das einfachste Verhältnis von Kalium- und Jodatomen in der Verbindung dar. Die Kaliumiodidformel wird verwendet, um die Menge einer Verbindung zu berechnen, die in verschiedenen Anwendungen benötigt wird, sowie um ihr Molekulargewicht und andere Eigenschaften zu bestimmen.
Molmasse von Kaliumiodid
KI hat eine Molmasse von etwa 166,0028 g/mol. Dieser Wert wird durch Addition der Atomgewichte von K und I in der Verbindung berechnet, die 39,0983 g/mol bzw. 126,9045 g/mol betragen. Die Molmasse von KI ist wichtig für die Bestimmung der Menge an Verbindung, die in einer bestimmten Reaktion oder Anwendung benötigt wird.
Siedepunkt von Kaliumiodid
Der Siedepunkt von KI beträgt 1330 °C (2426 °F). Dieser hohe Siedepunkt ist auf die starke Ionenbindung zwischen den Kalium- und Jodatomen in der Verbindung zurückzuführen. KI wird in Hochtemperaturanwendungen eingesetzt, da es extremer Hitze standhalten kann, ohne zusammenzubrechen oder seine Wirksamkeit zu verlieren.
Schmelzpunkt von Kaliumiodid
Der Schmelzpunkt von KI beträgt 681 °C (1.258 °F). Aufgrund dieses relativ niedrigen Schmelzpunkts ist KI bei moderaten Temperaturen leicht zu handhaben und zu verarbeiten. Aufgrund seines niedrigen Schmelzpunkts wird die Verbindung häufig bei der Herstellung von Fotofilmen, Pharmazeutika und Nuklearmedizin verwendet.
Dichte von Kaliumiodid g/ml
Die Dichte von KI beträgt 3,123 g/ml. Dieser Wert ist höher als der von Wasser, wodurch KI relativ schwer und dicht ist. Die Dichte von KI ist wichtig für die Bestimmung seiner Löslichkeit in verschiedenen Lösungsmitteln und für seine Anwendungen als Strahlenschutzmittel.
Molekulargewicht von Kaliumiodid
Das Molekulargewicht von KI beträgt etwa 166,0028 g/mol. Dieser Wert stellt die Summe der Atomgewichte der Bestandteile der Verbindung dar. Das Molekulargewicht von KI ist wichtig zur Bestimmung seiner Eigenschaften und zur Berechnung seiner Konzentration in Lösungen.
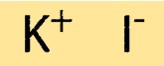
Struktur von Kaliumiodid
KI hat eine einfache Kristallstruktur, die aus einer flächenzentrierten kubischen Anordnung von K+-Ionen und I–Ionen besteht. Die Ionen werden durch starke Ionenbindungen zusammengehalten, die der Verbindung ihre hohen Schmelz- und Siedepunkte verleihen. Die Kristallstruktur von KI ist wichtig für das Verständnis seiner physikalischen und chemischen Eigenschaften.
| Aussehen | weißes kristallines Pulver |
| Spezifische Dichte | 3.123 |
| Farbe | farblos bis weiß |
| Geruch | geruchlos |
| Molmasse | 166,0028 g/Mol |
| Dichte | 3,123 g/ml |
| Fusionspunkt | 681 °C (1258 °F) |
| Siedepunkt | 1330 °C (2426 °F) |
| Blitzpunkt | ist nicht anwendbar |
| Löslichkeit in Wasser | 128g/100ml (20°C) |
| Löslichkeit | löslich in Ethanol, Aceton und Glycerin |
| Dampfdruck | unerheblich |
| Wasserdampfdichte | ist nicht anwendbar |
| pKa | 10.8 |
| pH-Wert | 6,0 – 9,0 (5 %ige Lösung) |
Sicherheit und Gefahren von Kaliumiodid
KI gilt bei sachgemäßer Anwendung im Allgemeinen als sicher. Allerdings kann es, wie alle Chemikalien, bei falscher Handhabung oder unsachgemäßer Verwendung Gefahren bergen. KI kann Haut, Augen und Atemwege reizen und eine längere Exposition kann schwerwiegendere gesundheitliche Auswirkungen haben. Es ist außerdem giftig, wenn es in großen Mengen eingenommen wird. Bei der Arbeit mit KI sollten die ordnungsgemäßen Handhabungs-, Lagerungs- und Entsorgungsverfahren befolgt werden. Darüber hinaus sollte beim Umgang mit der Verbindung persönliche Schutzausrüstung wie Handschuhe und Augenschutz getragen werden.
| Gefahrensymbole | XI |
| Sicherheitsbeschreibung | Einatmen von Staub/Rauch/Gas/Nebel/Dampf/Spray vermeiden. Schutzhandschuhe/Augenschutz/Gesichtsschutz tragen. BEI EINATMEN: Das Opfer an die frische Luft bringen und in einer Position ruhigstellen, die das Atmen erleichtert. BEI KONTAKT MIT DEN AUGEN: Einige Minuten lang vorsichtig mit Wasser spülen. Entfernen Sie Kontaktlinsen, falls vorhanden und einfach möglich. Spülen Sie weiter. |
| UN-Identifikationsnummern | UN 3077 |
| HS-Code | 28276000 |
| Gefahrenklasse | 9 – Verschiedene gefährliche Materialien |
| Verpackungsgruppe | III |
| Toxizität | LD50 (oral, Ratte) > 10.000 mg/kg |
Methoden zur Synthese von Kaliumiodid
Es gibt mehrere Methoden zur Synthese von KI, aber eine der gebräuchlichsten ist die Reaktion von Jod mit Kaliumhydroxid oder Kaliumcarbonat in Wasser. Die Gleichung für diese Reaktion lautet:
I2 + 2KOH → KI + KIO3 + H2O
Als Nebenprodukte entstehen bei dem Prozess KI, Kaliumjodat und Wasser. Durch Erhitzen der Mischung wird das Kaliumjodat zersetzt und reines KI zurückbleibt.
Eine andere Methode zur Synthese von KI beinhaltet die Reaktion von Jod mit Kaliumbisulfit in Wasser. Bei dieser Reaktion entstehen KI sowie Schwefeldioxidgas als Nebenprodukt. Die Gleichung für diese Reaktion lautet:
I2 + 2KHSO3 → 2KI + 2SO2 + H2O
Das erhaltene KI kann durch Umkristallisieren in heißem Wasser gereinigt werden.
Algen enthalten viel Jod, das Chemiker zur Gewinnung von KI nutzen können. Bei diesem Prozess werden Algen verbrannt, um Asche zu erzeugen, die Asche wird in Wasser gelöst und mit Kaliumhydroxid behandelt, um KI zu erzeugen.
Verwendung von Kaliumiodid
Hier sind einige häufige Anwendungen von KI:
- Strahlenschutz: Dient dem Schutz der Schilddrüse vor Strahlung im Falle eines Unfalls oder eines nuklearen Angriffs. Es wirkt, indem es die Schilddrüse mit nicht radioaktivem Jod sättigt, wodurch die Aufnahme radioaktiver Jodisotope verhindert wird.
- Medizinische Zwecke: Zur Behandlung von Schilddrüsenerkrankungen wie Hyperthyreose und Kropf. Wird auch als Nahrungsergänzungsmittel zur Vorbeugung von Jodmangel eingesetzt.
- Fotografie: Wird als Bestandteil in Fotoemulsionen verwendet.
- Analytische Chemie: Wird in der analytischen Chemie zur Bestimmung der Konzentration von Oxidationsmitteln in einer Probe verwendet.
- Organische Chemie: Wird in Reaktionen der organischen Chemie als Jodquelle verwendet.
- Tierernährung: Wird als Futterzusatz für Nutztiere verwendet, um Jodmangel vorzubeugen und die allgemeine Gesundheit zu verbessern.
- Stärkenachweis: Wird als Reagenz zum Nachweis des Vorhandenseins von Stärke in Lösungen verwendet.
- Reduktionsmittel: Wirkt bei bestimmten chemischen Reaktionen als Reduktionsmittel.
Fragen:
F: Wo kann ich Kaliumiodid in meiner Nähe kaufen?
A: Sie können KI in vielen Apotheken, Reformhäusern und Online-Händlern kaufen. Es wird häufig als Nahrungsergänzungsmittel oder als Strahlenschutzmittel verkauft.
F: Welche Kundengruppe sollte kein Kaliumiodid erhalten?
A: Menschen mit bestimmten Schilddrüsenerkrankungen oder Jodallergien sollten KI nicht einnehmen. Es ist wichtig, vor der Einnahme von Nahrungsergänzungsmitteln oder Medikamenten einen Arzt zu konsultieren.
F: Welche Lösung enthält 6,0 Prozent (m/m) Kaliumiodid (KI) in Wasser?
A: Eine 6,0-prozentige (m/m) Lösung von KI in Wasser bedeutet, dass 6,0 Gramm KI in 100 Gramm Wasser gelöst sind.
F: Was ist Kaliumiodid?
A: KI ist eine chemische Verbindung bestehend aus Kalium und Jod. Seine chemische Formel ist KI.
F: Ist KI ionisch oder kovalent?
A: Kaliumiodid (KI) ist eine ionische Verbindung. Es entsteht durch die elektrostatische Anziehung zwischen positiv geladenen Kaliumionen und negativ geladenen Jodidionen.
F: Ist KI wasserlöslich?
A: Ja, Kaliumiodid ist gut wasserlöslich. Bei Raumtemperatur können etwa 140 Gramm KI in 100 Milliliter Wasser gelöst werden.
F: Was ist KI in der Chemie?
A: In der Chemie ist KI die chemische Formel für Kaliumiodid, eine Verbindung, die in einer Vielzahl von Anwendungen verwendet wird, darunter Strahlenschutz, medizinische Zwecke und analytische Chemie.
