Magnesiumbromid (MgBr2) ist eine Verbindung aus Mg und Br. Es wird häufig als Katalysator bei organischen Synthesereaktionen und als Beruhigungsmittel in der Medizin verwendet.
| IUPAC-Name | Magnesiumbromid |
| Molekularformel | MgBr2 |
| CAS-Nummer | 7789-48-2 |
| Synonyme | Magnesiumdibromid, UN1913, Brommagnesit, Magnesium bromatum, Magnesiumbromid, Magnesiumbromid |
| InChI | InChI=1S/2BrH.Mg/h2*1H;/q;;+2/p-2 |
Eigenschaften von Magnesiumbromid
Magnesiumbromid-Formel
Die chemische Formel für Magnesiumbromid lautet MgBr2. Dies weist darauf hin, dass MgBr2 aus einem Mg+2-Ion und zwei Br–Ionen besteht. Die Formel stellt das Verhältnis der Atome in einem Molekül dar und spielt eine entscheidende Rolle bei der Bestimmung der Eigenschaften einer Verbindung. Die Formel für Magnesiumbromid weist darauf hin, dass es sich um eine ionische Verbindung mit einem hohen Schmelz- und Siedepunkt und einer starken ionischen Bindung zwischen Mg+2- und Bri–Ionen handelt.
Molmasse von Magnesiumbromid
Die Molmasse von MgBr2 beträgt 184,113 g/mol. Es ist die Summe der Atommassen von Magnesium und zwei Bromatomen. Die Molmasse ist ein entscheidender Parameter bei chemischen Berechnungen, da sie hilft, die Anzahl der Mol einer Substanz in einer bestimmten Menge einer Probe zu bestimmen. Die Molmasse von MgBr2 spielt eine entscheidende Rolle bei der Bestimmung der Menge der Verbindung, die für chemische Reaktionen benötigt wird.
Siedepunkt von Magnesiumbromid
MgBr2 hat einen Siedepunkt von 1.204 Grad Celsius oder 2.199 Grad Fahrenheit. Der Siedepunkt einer Verbindung ist die Temperatur, bei der ihr Dampfdruck dem Atmosphärendruck entspricht. Der hohe Siedepunkt von MgBr2 weist darauf hin, dass es sich um eine stabile Verbindung handelt, die hohen Temperaturen ohne Zersetzung standhalten kann. Diese Eigenschaft macht es für Hochtemperaturanwendungen wie Metallurgie und organische Synthesereaktionen nützlich.
Schmelzpunkt von Magnesiumbromid
MgBr2 hat einen Schmelzpunkt von 714 Grad Celsius oder 1.317 Grad Fahrenheit. Der Schmelzpunkt einer Verbindung ist die Temperatur, bei der sie vom festen in den flüssigen Zustand übergeht. Der hohe Schmelzpunkt von MgBr2 weist darauf hin, dass es sich um eine stabile Verbindung mit starken intermolekularen Kräften handelt. Diese Eigenschaft macht es als Reagenz bei chemischen Reaktionen bei hohen Temperaturen nützlich.
Dichte von Magnesiumbromid g/ml
Die Dichte von MgBr2 beträgt 3,72 g/ml. Die Dichte ist ein Maß für die Masse pro Volumeneinheit eines Stoffes. Die hohe Dichte von MgBr2 weist darauf hin, dass es sich um eine schwere Verbindung handelt, die im Wasser versinken kann. Diese Eigenschaft macht es in verschiedenen Anwendungen nützlich, beispielsweise in der anorganischen Synthese und als Beruhigungsmittel in der Medizin.
Molekulargewicht von Magnesiumbromid
Das Molekulargewicht von MgBr2 beträgt 184,113 g/mol. Es ist die Summe der Atommassen von Magnesium und zwei Bromatomen. Das Molekulargewicht spielt eine entscheidende Rolle bei der Bestimmung der chemischen und physikalischen Eigenschaften einer Verbindung. Das Molekulargewicht von MgBr2 beeinflusst seine Reaktivität und Löslichkeit in verschiedenen Lösungsmitteln.
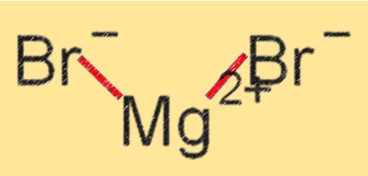
Struktur von Magnesiumbromid
MgBr2 hat eine Kristallgitterstruktur, in der die Mg+2- und Br–Ionen durch Ionenbindungen zusammengehalten werden. Es ist ein weißer kristalliner Feststoff, der in Wasser und anderen polaren Lösungsmitteln gut löslich ist. Die Kristallgitterstruktur von MgBr2 trägt zu seinen hohen Schmelz- und Siedepunkten sowie zu seiner Stabilität bei verschiedenen chemischen Reaktionen bei.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 3,72 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 184.113 g/Mol |
| Dichte | 3,72 g/ml |
| Fusionspunkt | 714 °C (1.317 °F) |
| Siedepunkt | 1204 °C (2199 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Wasser, Ethanol, Aceton und Ether |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Neutral |
Sicherheit und Gefahren von Magnesiumbromid
MgBr2 gilt im Allgemeinen als sicher, wenn es richtig gehandhabt wird. Allerdings kann es, wie jede chemische Verbindung, Gefahren bergen, wenn es nicht sorgfältig gehandhabt wird. MgBr2 ist ätzend und kann schwere Haut- und Augenreizungen verursachen. Das Einatmen von MgBr2-Staub oder -Dämpfen kann zu Reizungen der Atemwege führen. Beim Umgang mit MgBr2 ist das Tragen von Schutzkleidung und Atemschutzgeräten wichtig. MgBr2 kann auch heftig mit bestimmten Chemikalien wie Wasser oder Säuren reagieren und dabei Bromwasserstoffgas erzeugen. Daher ist es wichtig, MgBr2 getrennt von inkompatiblen Substanzen und in einem gut belüfteten Bereich zu lagern und zu handhaben.
| Gefahrensymbole | Ätzend |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. Schutzkleidung und Atemschutzgerät tragen. Handhaben Sie das Produkt und lagern Sie es getrennt von unverträglichen Substanzen. |
| UN-Identifikationsnummern | UN2920 |
| HS-Code | 2827.59.90 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | II |
| Toxizität | Bei sachgemäßer Handhabung geringe Toxizität. Kann Haut- und Augenreizungen verursachen. Das Einatmen von Staub oder Dämpfen kann zu Reizungen der Atemwege führen. |
Methoden zur Synthese von Magnesiumbromid
MgBr2 kann auf verschiedene Weise synthetisiert werden.
Eine gängige Methode ist die Reaktion zwischen metallischem Magnesium und Bromwasserstoffgas . Bei diesem Prozess wird Bromwasserstoffgas über Mg-Metall geleitet, wodurch MgBr2 und Wasserstoffgas entstehen.
Eine weitere Methode ist die Reaktion zwischen Magnesiumoxid oder Magnesiumhydroxid und Bromwasserstoffsäure . Bei diesem Prozess entstehen als Produkte MgBr2 und Wasser.
Darüber hinaus kann MgBr2 durch die Reaktion zwischen Magnesiumcarbonat und Bromwasserstoffsäure oder durch die Reaktion zwischen Magnesiumsulfat und NaBr synthetisiert werden.
Bei diesen Methoden werden die Reagenzien gemischt und die Reaktion ablaufen gelassen, was zur Bildung von MgBr2 führt.
Verwendung von Magnesiumbromid
MgBr2 wird in verschiedenen Branchen vielfältig eingesetzt. Hier sind einige seiner häufigsten Anwendungen:
- In der organischen Synthese: Wird als Lewis-Säure-Katalysator in organischen Synthesereaktionen wie der Grignard-Reaktion verwendet, bei der Kohlenstoff-Kohlenstoff-Bindungen gebildet werden.
- Bei der Herstellung von Flammschutzmitteln: Flammschutzmittel, die Materialien schwerer entflammbar machen, nutzen es als entscheidenden Bestandteil bei ihrer Herstellung.
- In der Öl- und Gasindustrie: Wird als Komplettierungsflüssigkeit in Öl- und Gasbohrlöchern verwendet, um den Druck aufrechtzuerhalten und den Zusammenbruch des Bohrlochs zu verhindern.
- In Arzneimitteln: Wird als Wirkstoff in einigen Arzneimitteln wie Beruhigungsmitteln und Antikonvulsiva verwendet.
- In der Elektrochemie: Wird als Elektrolyt in Batterien und anderen elektrochemischen Geräten verwendet.
- In der Metallproduktion: Wird als Flussmittel bei der Herstellung bestimmter Metalle wie Aluminium und Titan verwendet.
- In der analytischen Chemie: Wird als Reagenz in der analytischen Chemie zur Bestimmung verschiedener Elemente wie Bor und Fluorid verwendet.
Fragen:
F: Wie lautet die chemische Formel von Magnesiumbromid?
A: Die chemische Formel für Magnesiumbromid lautet MgBr2.
F: Ist Magnesiumbromid ionisch oder kovalent?
A: MgBr2 ist eine ionische Verbindung.
F: Wie lautet die Formel für Magnesiumbromid?
A: Die Formel für Magnesiumbromid lautet MgBr2.
F: Ist Magnesiumbromid wasserlöslich?
A: Ja, MgBr2 ist wasserlöslich. Es ist gut wasserlöslich und kann sich zu einer klaren, farblosen Lösung auflösen.
F: Wie lautet die Formel für Magnesiumbromid?
A: Die Formel für Magnesiumbromid lautet MgBr2.
