Natriumfluorid (NaF) ist eine chemische Verbindung, die zur Vorbeugung von Karies eingesetzt wird. Es stärkt den Zahnschmelz durch Remineralisierung und hemmt das Wachstum schädlicher Mundbakterien.
| Name der IUPAC | Natriumfluorid |
| Molekularformel | NaF |
| CAS-Nummer | 7681-49-4 |
| Synonyme | Natriummonofluorid, wasserfreies Natriumfluorid, Mononatriumfluorid, Natriumfluorid, |
| Solutia SFL, Fluka 01178, 3M ESPE 12104, Puriss. Natriumfluorid, Extrareines Natriumfluorid | |
| InChI | InChI=1S/FH.Na/h1H;/q;+1/p-1 |
Eigenschaften von Natriumfluorid
Natriumfluorid-Formel
Die chemische Formel für Natriumfluorid lautet NaF. Das bedeutet, dass jedes NaF-Molekül aus einem Na+-Ion und einem F–Ion besteht. Die Formel ist in der Chemie wichtig, weil sie Auskunft über die Art und Anzahl der Atome oder Ionen in einem Molekül einer Substanz gibt.
Molmasse von Natriumfluorid
Die Molmasse von NaF beträgt 41,99 g/mol. Es ist die Summe der Atommassen eines Natriumatoms und eines Fluoratoms, die 22,99 g/mol bzw. 19,00 g/mol betragen. Die Molmasse ist eine wichtige Eigenschaft in der Chemie, da sie es Ihnen ermöglicht, die Molzahl einer Substanz anhand ihrer Masse zu berechnen und umgekehrt.
Siedepunkt von Natriumfluorid
Der Siedepunkt von NaF beträgt 1705 °C (3101 °F). Dies ist die Temperatur, bei der die flüssige Form von NaF in seine Gasform übergeht. NaF hat im Vergleich zu anderen F-Verbindungen aufgrund seiner starken ionischen Bindung zwischen Na+-Ionen und F–Ionen einen relativ hohen Siedepunkt.
Schmelzpunkt von Natriumfluorid
Der Schmelzpunkt von NaF beträgt 993 °C (1.819 °F). Dies ist die Temperatur, bei der die feste Form von NaF in seine flüssige Form übergeht. NaF hat aufgrund seiner starken ionischen Bindung zwischen Na+-Ionen und F–Ionen einen relativ hohen Schmelzpunkt.
Dichte von Natriumfluorid g/ml
Die Dichte von NaF beträgt 2,79 g/ml. Das bedeutet, dass ein Milliliter NaF 2,79 Gramm wiegt. Die Dichte ist eine wichtige Eigenschaft eines Stoffes, da sie dazu verwendet werden kann, die Masse eines Stoffes anhand seines Volumens oder das Volumen eines Stoffes anhand seiner Masse zu bestimmen.
Molekulargewicht von Natriumfluorid
Das Molekulargewicht von NaF beträgt 41,99 g/mol. Es ist die Summe der Atomgewichte von Natrium und Fluor in einem NaF-Molekül. Das Molekulargewicht ist in der Chemie wichtig, da es dabei hilft, verschiedene Eigenschaften einer Substanz zu berechnen, beispielsweise ihre Dichte und Molarität.
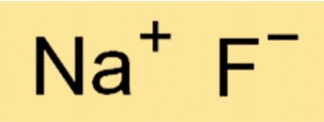
Struktur von Natriumfluorid
NaF hat in fester Form eine kristalline Struktur. Es besteht aus Na+-Ionen und F–Ionen, die in einer kubischen Gitterstruktur angeordnet sind. Na+-Ionen besetzen die Ecken des Würfels, während Fluoridionen die Mittelpunkte der Würfelflächen besetzen. Diese Anordnung führt zu einer starken Ionenbindung zwischen den Na+-Ionen und den F–Ionen.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2,79 g/cm³ |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 41,99 g/Mol |
| Dichte | 2,79 g/ml |
| Fusionspunkt | 993 °C (1.819 °F) |
| Siedepunkt | 1705 °C (3101 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 4,24 g/100 ml (20 °C) |
| Löslichkeit | Löslich in Alkohol und Ether |
| Dampfdruck | 1 mmHg (713 °C) |
| Wasserdampfdichte | 2,9 (Luft = 1) |
| pKa | 7.2 |
| pH-Wert | 7,6–8,4 (0,1 M wässrige Lösung) |
Sicherheit und Gefahren von Natriumfluorid
NaF weist einige Sicherheits- und Gefahrenprobleme auf. Bei Einnahme großer Mengen ist es giftig und kann Übelkeit, Erbrechen, Durchfall und Bauchschmerzen verursachen. Das Einatmen von NaF-Staub kann zu Atemwegsreizungen und Lungenschäden führen. Bei Kontakt kann es außerdem zu Augen- und Hautreizungen kommen. NaF wirkt auch gegenüber einigen Metallen korrosiv und kann mit starken Säuren heftig reagieren. Bei der Arbeit mit NaF sollten ordnungsgemäße Handhabungs-, Lagerungs- und Entsorgungsverfahren befolgt werden, um diese Gefahren zu vermeiden. Beim Umgang mit NaF ist es wichtig, stets geeignete persönliche Schutzausrüstung zu tragen.
| Gefahrensymbole | T,N |
| Sicherheitsbeschreibung | Verschlucken, Einatmen sowie Haut- und Augenkontakt vermeiden. Tragen Sie geeignete PSA. Befolgen Sie die Verfahren zur sicheren Handhabung, Lagerung und Entsorgung. |
| UN-Identifikationsnummern | UN1690 (für Feststoff) |
| HS-Code | 2826.12.00 |
| Gefahrenklasse | 6.1 (Giftige Stoffe) |
| Verpackungsgruppe | II |
| Toxizität | Giftig, wenn große Mengen verschluckt oder eingeatmet werden. Kann Reizungen der Atemwege, Augen und Haut verursachen. Korrosiv gegenüber bestimmten Metallen. |
Methoden zur Synthese von Natriumfluorid
Chemiker verwenden verschiedene Methoden, um Natriumfluorid (NaF) zu synthetisieren.
Eine übliche Methode ist die Reaktion von Flusssäure mit Natriumhydroxid oder Natriumcarbonat . Um Wasser oder Verunreinigungen zu entfernen, trocknet und erhitzt jemand das resultierende Produkt.
Eine andere Methode beinhaltet die Reaktion von NaCl mit HF , wobei als Nebenprodukte NaF und Chlorwasserstoff entstehen. Diese Methode ist aufgrund von Sicherheitsbedenken im Zusammenhang mit der Handhabung von Fluorwasserstoff weniger verbreitet.
Eine andere Möglichkeit, NaF zu synthetisieren, ist die Reaktion von Natriumcarbonat mit HF -Gas. Bei der Reaktion entstehen NaF, Kohlendioxid und Wasserdampf. Industrielle Anwendungen nutzen diese Methode üblicherweise zur Herstellung von NaF.
Darüber hinaus kann NaF durch Erhitzen von Fluorgas mit metallischem Natrium synthetisiert werden. Aufgrund der hohen Reaktivität von Natrium und Fluor ist diese Methode jedoch selten. Darüber hinaus erfordert diese Methode aufgrund der Explosionsgefahr eine spezielle Ausrüstung und eine sorgfältige Handhabung.
Verwendungsmöglichkeiten von Natriumfluorid
NaF hat verschiedene Verwendungszwecke in verschiedenen Sektoren. Hier sind einige häufige Verwendungen von NaF:
- Zahnhygiene: Zahnpasta, Mundspülungen und Zahnbehandlungen enthalten NaF, um Zahnkaries vorzubeugen und die Mundgesundheit zu verbessern.
- Wasseraufbereitung: Wird in manchen Gegenden dem Trinkwasser zugesetzt, um Karies vorzubeugen.
- Industrielle Anwendungen: Wird als Flussmittel in der Aluminiumproduktion sowie in der Glas- und Keramikproduktion verwendet, um den Schmelzpunkt zu senken und die Transparenz zu verbessern.
- Metallurgie: Wird bei der Raffinierung und Verarbeitung von Metallen verwendet, beispielsweise zur Entfernung von Verunreinigungen bei der Herstellung von Stahl und Aluminium.
- Pestizid: Wird als Pestizid im Kampf gegen Nagetiere und Insekten eingesetzt.
- Chemie: Wird als Quelle für Fluoridionen in verschiedenen chemischen Reaktionen verwendet.
- Nuklearindustrie: Wird in einigen Kernreaktoren als Kühlmittel und Wärmeübertragungsmittel verwendet.
- Pharmazeutika: werden zur Herstellung bestimmter Medikamente wie Antidepressiva und Entzündungshemmer verwendet.
Fragen:
F: Ist Natriumfluorid in Zahnpasta gesundheitsschädlich?
A: NaF in Zahnpasta gilt im Allgemeinen als sicher, wenn es bestimmungsgemäß verwendet wird. Es hilft, Karies vorzubeugen und ist von Zahnärztekammern auf der ganzen Welt anerkannt. Allerdings kann die übermäßige Einnahme von Zahnpasta zu Magenbeschwerden und anderen Gesundheitsproblemen führen.
F: Hätte eine verdünnte oder konzentrierte Natriumfluoridlösung einen höheren Siedepunkt?
A: Eine konzentrierte NaF-Lösung hätte einen höheren Siedepunkt als eine verdünnte Lösung, da die Lösung eine größere Anzahl gelöster Stoffpartikel enthält, was den Siedepunkt durch den punkterhöhenden Effekt des Siedens erhöht.
F: Wie viele Gramm sind in 4,5 Mol Natriumfluorid enthalten?
A: Die Molmasse von NaF beträgt 41,99 g/mol, also wären 4,5 Mol NaF 188,96 Gramm.
F: Ist Natriumfluorid ionisch oder kovalent?
A: NaF ist eine ionische Verbindung, die durch die elektrostatische Anziehung zwischen dem Na+-Ion und dem F–Ion entsteht.
F: Wie stellt man die ionische Verbindung Natriumfluorid richtig dar?
A: Die korrekte Darstellung dieser ionischen Verbindung ist NaF, wobei Na für Na+ und F für F- steht.
F: Wie heißt die Verbindung mit der Formel NaF?
A: Der Name der Verbindung mit der Formel NaF ist Natriumfluorid.
F: Ist NaF eine Säure oder eine Base?
A: NaF ist ein Salz, das durch die Neutralisationsreaktion zwischen einer starken Base (Natriumhydroxid) und einer schwachen Säure (Flusssäure) entsteht. Es ist weder eine Säure noch eine Base, kann aber durch Hydrolyse eine basische Lösung bilden.
