Ethylacetat ist eine farblose Flüssigkeit mit fruchtigem Geruch. Es wird häufig als Lösungsmittel in verschiedenen Branchen verwendet, darunter in der Pharma-, Kosmetik- und Lebensmittelindustrie. Ethylacetat ist leicht entzündlich und sollte mit Vorsicht gehandhabt werden.
| IUPAC-Name | Ethylacetat |
| Molekularformel | C4H8O2 |
| CAS-Nummer | 141-78-6 |
| Synonyme | Essigsäureethylester, Ethylethanoat, Acetoxyethan, Acetidin, Ethylacetat, Ethylessigsäureester |
| InChI | InChI=1S/C4H8O2/c1-3-6-4(2)5/h3H2.1-2H3 |
Eigenschaften von Ethylacetat
Dichte von Ethylacetat g/ml
Die Dichte von Ethylethanoat beträgt unter Standardtemperatur- und Druckbedingungen 0,902 g/ml. Diese Dichte zeigt an, dass Ethylethanoat eine geringere Dichte als Wasser hat und darauf schwimmt. Diese Eigenschaft macht es nützlich für die Trennung von Flüssigkeitsgemischen durch den Flüssig-Flüssig-Extraktionsprozess.
Struktur von Ethylacetat
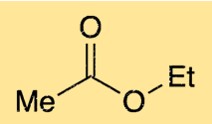
Die Struktur von Ethylethanoat besteht aus einer Kette mit vier Kohlenstoffatomen und einer funktionellen Estergruppe. Die funktionelle Estergruppe besteht aus einem Sauerstoffatom, das an ein Kohlenstoffatom gebunden ist, das wiederum an ein anderes Sauerstoffatom gebunden ist. Das Sauerstoffatom der Estergruppe ist auch an eines der Kohlenstoffatome in der Vierkohlenstoffkette gebunden. Diese Struktur verleiht Ethylethanoat seinen charakteristischen fruchtigen Geruch.
Molmasse von Ethylacetat
Die Molmasse von Ethylacetat beträgt 88,11 g/mol. Sie wird durch Addition der Atomgewichte aller Atome in einem Ethylacetatmolekül bestimmt. Die Summenformel für Ethylacetat lautet C4H8O2, was bedeutet, dass jedes Molekül 4 Kohlenstoffatome, 8 Wasserstoffatome und 2 Sauerstoffatome enthält. Die Molmasse von Ethylacetat wird in vielen Berechnungen verwendet, beispielsweise zur Bestimmung der Substanzmenge in einer bestimmten Probe oder der Masse einer Substanz in einem bestimmten Volumen.
Siedepunkt von Ethylacetat
Der Siedepunkt von Ethylethanoat beträgt 77,1 °C (171,8 °F) bei Normaldruck. Ethylethanoat hat einen relativ niedrigen Siedepunkt, wodurch es in vielen industriellen Anwendungen als Lösungsmittel für Extraktion, Reinigung und Reinigung nützlich ist. Beim Erhitzen auf den Siedepunkt verdampft Ethylethanoat und kann durch Kondensation als reine Flüssigkeit gesammelt werden.
Schmelzpunkt von Ethylacetat
Der Schmelzpunkt von Ethylethanoat beträgt -83,6 °C (-118,5 °F). Dieser niedrige Schmelzpunkt bedeutet, dass Ethylethanoat bei Raumtemperatur normalerweise in flüssiger Form und nicht in fester Form vorkommt. Allerdings kann es bei extrem niedrigen Temperaturen oder unter Druck erstarren. Die feste Form von Ethylethanoat ist normalerweise ein weißes kristallines Pulver.
Molekulargewicht von Ethylacetat
Das Molekulargewicht von Ethylethanoat beträgt 88,11 g/mol. Dieser Wert stellt die Masse eines Mols Ethylethanoat-Moleküle dar. Das Molekulargewicht wird in vielen Berechnungen verwendet, beispielsweise zur Bestimmung der Substanzmenge in einer bestimmten Probe oder der Masse einer Substanz in einem bestimmten Volumen.
Ethylacetat-Formel
Die chemische Formel für Ethylethanoat lautet C4H8O2. Diese Formel stellt die Anzahl und Art der Atome dar, aus denen ein Ethylethanoat-Molekül besteht. Die vier Kohlenstoffatome in der Formel sind in einer Kette angeordnet, wobei jedes Kohlenstoffatom an zwei andere Atome gebunden ist. Zwei der Kohlenstoffatome sind auch an die Sauerstoffatome in der funktionellen Estergruppe gebunden. Die verbleibenden zwei Kohlenstoffatome sind an jeweils drei Wasserstoffatome gebunden.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 0,902 g/cm³ |
| Farbe | Farblos |
| Geruch | Fruchtig, süß |
| Molmasse | 88,11 g/Mol |
| Dichte | 0,902 g/cm³ |
| Fusionspunkt | -83,6°C |
| Siedepunkt | 77,1°C |
| Blitzpunkt | -4°C |
| Löslichkeit in Wasser | 80 g/L bei 20°C |
| Löslichkeit | Löslich in Alkohol, Ether, Aceton, Chloroform |
| Dampfdruck | 73,3 mmHg bei 20°C |
| Wasserdampfdichte | 3.04 |
| pKa | 4,76 |
| pH-Wert | Neutral |
Ethylethanoat ist eine farblose Flüssigkeit, die häufig in verschiedenen Industrie- und Laboranwendungen eingesetzt wird. Es birgt jedoch bestimmte Sicherheits- und Gesundheitsrisiken, die berücksichtigt werden müssen, um eine sichere Handhabung und Verwendung zu gewährleisten. Der Kontakt mit Ethylethanoat kann zu Reizungen der Augen, der Haut und der Atemwege führen. Es kann auch Kopfschmerzen, Schwindel und Übelkeit verursachen. Ethylethanoat ist brennbar und kann bei Einwirkung von Hitze oder Flammen Brände oder Explosionen verursachen. Es ist wichtig, Ethylethanoat an einem gut belüfteten Ort und fern von Zündquellen zu lagern und zu handhaben. Im Falle einer versehentlichen Exposition sollte sofort ein Arzt aufgesucht werden, um weitere Schäden zu verhindern. Beim Umgang mit Ethylethanoat sollten geeignete Sicherheitsvorkehrungen und Schutzausrüstung verwendet werden, um das Risiko von Verletzungen oder Schäden zu minimieren.
| Gefahrensymbole | Xi, F |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. Von Zündquellen fernhalten. In einem gut belüfteten Bereich verwenden. |
| AN-Kennungen | UN1173 |
| HS-Code | 2915.31.00 |
| Gefahrenklasse | 3 – Brennbare Flüssigkeiten |
| Verpackungsgruppe | GE II |
| Toxizität | LD50 (oral, Ratte) – 2 g/kg |
Methoden zur Synthese von Ethylacetat
Zwei Hauptmethoden, Veresterung und Dehydrierung, ermöglichen die aktive Synthese von Ethylethanoat in der Industrie mit hohen Ausbeuten.
Bei der Veresterungsmethode handelt es sich um die Reaktion zwischen Ethanol und Essigsäure in Gegenwart eines stark sauren Katalysators wie Schwefelsäure. Durch Destillation werden das bei der Reaktion entstehende Ethylethanoat und das Wasser getrennt, um hohe Ausbeuten an Ethylethanoat zu erzeugen, das üblicherweise in der Industrie verwendet wird.
Bei der Dehydrierungsmethode werden Ethanol und Essigsäure an einem Kupfer(II)-Oxid-Katalysator bei hoher Temperatur umgesetzt. Der Katalysator fördert die Dehydrierung von Ethanol zu Ethylen, das dann mit Essigsäure zu Ethylethanoat reagiert. Diese Methode ist weniger verbreitet als die Veresterung und erfordert im Allgemeinen höhere Temperaturen und längere Reaktionszeiten.
Eine andere Methode zur Synthese von Ethylethanoat beinhaltet die Reaktion von Ethanol und Essigsäureanhydrid. Bei dieser Methode entstehen Ethylethanoat und Essigsäure, die durch Destillation getrennt werden können.
Verwendung von Ethylacetat
Ethylethanoat ist eine vielseitige chemische Verbindung, die in verschiedenen Industrie- und Verbraucheranwendungen weit verbreitet ist. Einige der häufigsten Anwendungen von Ethylethanoat sind:
- Lösungsmittel: Hersteller verwenden es als starkes Lösungsmittel in Farben, Beschichtungen und Klebstoffen.
- Aromastoff: Wird als Aromastoff in der Lebensmittel- und Getränkeindustrie, insbesondere bei der Herstellung von Getränken mit Fruchtgeschmack, verwendet.
- Duft: Aufgrund seines angenehm fruchtigen Geruchs ein häufiger Bestandteil von Parfüms, Eau de Cologne und anderen Körperpflegeprodukten.
- Extraktion ätherischer Öle: Wird zur Extraktion ätherischer Öle aus Pflanzen und Blumen verwendet.
- Arzneimittel: Wird als Lösungsmittel bei der Herstellung von Arzneimitteln, insbesondere bei der Herstellung von Antibiotika, verwendet.
- Reinigungsmittel: dient zur Reinigung elektronischer Geräte, Textilien und anderer Materialien.
- Kunstleder: Hersteller von Kunstleder machen das Material weicher und geschmeidiger, indem sie Ethylacetat als Weichmacher verwenden.
- Chemisches Zwischenprodukt: Chemikalienhersteller stellen andere Chemikalien wie Celluloseacetat, Vinylacetat und Ethylacrylat her und verwenden dabei Ethylethanoat als chemisches Zwischenprodukt.
Fragen:
F: Ist Ethylacetat polar oder unpolar?
A: Ethylethanoat ist aufgrund der Anwesenheit einer Carbonylgruppe (C=O) und eines Sauerstoffatoms in seiner Molekülstruktur ein polares Lösungsmittel. Allerdings ist es nicht so polar wie andere Lösungsmittel wie Wasser oder Ethanol.
F: Ist Ethylacetat mit Wasser mischbar?
A: Ethylethanoat ist mit Wasser nicht mischbar, was bedeutet, dass es sich nicht gut mit Wasser vermischt. Dies ist auf den Polaritätsunterschied zwischen den beiden Substanzen zurückzuführen, da Wasser ein stark polares Lösungsmittel und Ethylethanoat ein weniger polares Lösungsmittel ist.
F: Ist Ethylacetat wasserlöslich?
A: Ethylethanoat ist in Wasser leicht löslich, mit einer Löslichkeit von etwa 8 % bei Raumtemperatur. Allerdings ist diese Löslichkeit aufgrund der unterschiedlichen Polarität der beiden Stoffe begrenzt. Ethylethanoat ist in unpolaren Lösungsmitteln wie Hexan oder Toluol besser löslich.
