Methanol (CH3OH) ist eine farblose, brennbare Flüssigkeit mit süßem Geruch. Es wird als Lösungsmittel, Kraftstoff und Frostschutzmittel verwendet. Bei Verschlucken kann es giftig sein und zur Erblindung oder zum Tod führen.
| IUPAC-Name | Methanol |
| Molekularformel | CH4O |
| CAS-Nummer | 67-56-1 |
| Synonyme | Methylalkohol, Holzalkohol, Hydroxymethan, Carbinol, Holznaphtha, Kolonialspiritus |
| InChI | InChI=1S/CH4O/c1-2/h2H,1H3 |
Hinweis: InChI ist eine lange Kette, die die einzigartige Struktur eines Moleküls darstellt. Auf einigen Geräten wird die Darstellung möglicherweise nicht korrekt dargestellt.
Eigenschaften von Methanol
Methanol Molmasse
Die Molmasse von Methanol beträgt 32,04 g/mol. Sie wird durch Addition der Atomgewichte der Kohlenstoff-, Wasserstoff- und Sauerstoffatome in einem einzelnen Methanolmolekül berechnet. Dieser Wert ist nützlich, um die Methanolmenge zu bestimmen, die zur Herstellung einer bestimmten Konzentration einer Lösung benötigt wird, oder um die Stöchiometrie einer chemischen Reaktion zu bestimmen.
Siedepunkt von Methanol
Methanol hat einen Siedepunkt von 64,7 °C (148,46 °F). Dieser relativ niedrige Siedepunkt macht Methanol als Lösungsmittel in verschiedenen industriellen Anwendungen nützlich, einschließlich der Herstellung von Formaldehyd, Essigsäure und Methylmethacrylat. Der niedrige Siedepunkt von Methanol macht es jedoch auch flüchtig und entflammbar, was bei Lagerung, Handhabung und Transport ein Sicherheitsrisiko darstellen kann.
Schmelzpunkt von Methanol
CH3OH hat einen Schmelzpunkt von -97,6 °C (-143,68 °F). Dies bedeutet, dass CH3OH bei Raumtemperatur flüssig ist, aber durch Abkühlen unter seinen Schmelzpunkt leicht in feste Form eingefroren werden kann. Der niedrige Schmelzpunkt von CH3OH ist auch in einigen Laboranwendungen nützlich, beispielsweise bei der Herstellung kryogener Lösungsmittel für die Kernspinresonanzspektroskopie.
Dichte von Methanol g/ml
Die Dichte von CH3OH beträgt 0,792 g/ml bei 20 °C (68 °F). Das bedeutet, dass CH3OH eine geringere Dichte als Wasser hat und darauf schwimmen kann. Die Dichte von CH3OH kann auch verwendet werden, um das Volumen an CH3OH zu berechnen, das benötigt wird, um eine bestimmte Masse oder Konzentration der Lösung zu erhalten.
Molekulargewicht von Methanol
Das Molekulargewicht von CH3OH beträgt 32,04 g/mol. Dieser Wert wird durch Addition der Atomgewichte der Kohlenstoff-, Wasserstoff- und Sauerstoffatome in einem einzelnen CH3OH-Molekül berechnet. Das Molekulargewicht von CH3OH ist nützlich zur Bestimmung seiner physikalischen Eigenschaften, wie Siedepunkt, Schmelzpunkt und Dichte.
Struktur von Methanol
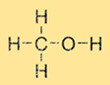
Methanol hat eine einfache Struktur, die aus einer Methylgruppe (CH3) und einer Hydroxylgruppe (-OH) besteht, die an ein einzelnes Kohlenstoffatom gebunden sind. Die Summenformel für Methanol lautet CH3OH. Methanol ist aufgrund der Anwesenheit der Hydroxylgruppe ein polares Molekül, das es in polaren Lösungsmitteln wie Wasser und Ethanol löslich macht.
Methanol-Formel
Die chemische Formel für Methanol lautet CH3OH. Das bedeutet, dass jedes Methanolmolekül ein Kohlenstoffatom, vier Wasserstoffatome und ein Sauerstoffatom enthält. Mit der Methanolformel können das Molekulargewicht und andere physikalische Eigenschaften von Methanol bestimmt werden. Die chemische Formel von Methanol eignet sich auch zum Schreiben chemischer Gleichungen und zum Ausbalancieren chemischer Reaktionen mit Methanol.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 0,792 g/ml bei 20 °C |
| Farbe | Farblos |
| Geruch | Süß, würzig |
| Molmasse | 32,04 g/Mol |
| Dichte | 0,792 g/ml bei 20 °C |
| Fusionspunkt | -97,6°C |
| Siedepunkt | 64,7°C |
| Blitzpunkt | 11,1°C |
| Löslichkeit in Wasser | Mischbar |
| Löslichkeit | Mischbar mit Ethanol, Ether, Aceton und vielen organischen Lösungsmitteln |
| Dampfdruck | 13,02 kPa bei 20°C |
| Wasserdampfdichte | 1,11 (Luft = 1) |
| pKa | 15.5 |
| pH-Wert | 7 (neutral) |
Hinweis: Die in dieser Tabelle aufgeführten Werte sind Näherungswerte und können je nach spezifischen Bedingungen und Methanolquellen variieren.
Sicherheit und Gefahren von Methanol
CH3OH birgt verschiedene Sicherheitsrisiken und sollte mit Vorsicht gehandhabt werden. Es ist eine brennbare Flüssigkeit und kann sich entzünden, wenn es Hitze, Funken oder Flammen ausgesetzt wird. CH3OH-Dämpfe können mit Luft auch explosionsfähige Gemische bilden. Das Einatmen von CH3OH-Dämpfen kann Schwindel, Kopfschmerzen, Übelkeit und andere Gesundheitsprobleme verursachen. CH3OH ist außerdem giftig und kann über die Haut aufgenommen oder eingenommen werden, was zu schwerwiegenden gesundheitlichen Komplikationen wie Blindheit, Koma und Tod führen kann. Es ist wichtig, Schutzkleidung zu tragen und CH3OH in einem gut belüfteten Bereich mit geeigneter Sicherheitsausrüstung wie Schutzbrille, Handschuhen und Atemschutzgerät zu handhaben. Verschüttungen sollten sofort beseitigt und ordnungsgemäß entsorgt werden.
| Gefahrensymbole | Totenkopf mit gekreuzten Knochen, brennbar |
| Sicherheitsbeschreibung | Von Hitze/Funken/offener Flamme/heißen Oberflächen fernhalten. Explosionsgeschützte Elektro-/Lüftungs-/Beleuchtungsgeräte verwenden. Halten Sie den Behälter fest verschlossen. Boden-/Bügelcontainer und Empfangsausrüstung. Verwenden Sie nur funkenfreie Werkzeuge. Treffen Sie Vorsichtsmaßnahmen gegen statische Entladung. Vermeiden Sie das Einatmen von Dämpfen. Nach der Handhabung gut waschen. Essen, trinken oder rauchen Sie nicht, während Sie dieses Produkt verwenden. |
| AN-Kennungen | UN1230 |
| HS-Code | 29051100 |
| Gefahrenklasse | 3 |
| Verpackungsgruppe | II |
| Toxizität | Methanol ist giftig und kann bei Verschlucken, Einatmen oder Aufnahme über die Haut zu Blindheit, Koma und Tod führen. Bei Kontakt kann es außerdem zu Reizungen, Rötungen und Verbrennungen kommen. Der Kontakt mit Methanoldämpfen kann Kopfschmerzen, Schwindel, Übelkeit und andere gesundheitliche Probleme verursachen. Methanol sollte mit äußerster Vorsicht und entsprechender Schutzausrüstung gehandhabt werden. |
Hinweis: Die in dieser Tabelle aufgeführten Werte sind Näherungswerte und können je nach spezifischen Bedingungen und Methanolquellen variieren. Beim Umgang mit Methanol ist es wichtig, das Sicherheitsdatenblatt und die geltenden Vorschriften zu beachten.
Methoden der Methanolsynthese
Durch die direkte Oxidation von Methan, die partielle Oxidation von Erdgas, die Vergasung von Kohle und die Synthese aus Kohlendioxid und Wasserstoff wird Methanol synthetisiert.
Eine der gebräuchlichsten Methoden zur Synthese von Methanol ist die katalytische Umwandlung des Synthesegases, einer Mischung aus Kohlenmonoxid, Kohlendioxid und Wasserstoff. Bei diesem Verfahren wird ein Katalysator, meist auf Kupferbasis, verwendet, um die Reaktion zu erleichtern. Das Synthesegas wird bei hohen Temperaturen und Drücken in einen Reaktor eingeleitet, der den Katalysator enthält, was zur Produktion von Methanol führt.
Eine andere Methode zur Synthese von Methanol beinhaltet die direkte Oxidation von Methan, wobei hohe Temperaturen und Drücke in Gegenwart eines Katalysators wie Platin oder Palladium eingesetzt werden. Diese Methode ist schwieriger und teurer als die Synthesegasmethode, aber sie ist effizienter und kann höhere Erträge liefern.
Die teilweise Oxidation von Erdgas ist eine weitere Methode der Methanolsynthese, bei der Sauerstoff oder Luft zur teilweisen Oxidation von Erdgas verwendet werden, wodurch eine Mischung aus Kohlenmonoxid und Wasserstoff entsteht. Die Mischung wird dann in einen Reaktor mit einem Katalysator eingeleitet, wodurch Methanol entsteht.
Die Kohlevergasung ist eine weitere Methode der Methanolsynthese, bei der Kohle in Synthesegas umgewandelt wird, gefolgt von demselben katalytischen Umwandlungsprozess wie oben beschrieben.
Durch die Kohlenstoffabscheidung und -nutzung werden Kohlendioxidemissionen aus industriellen Prozessen in Methanol umgewandelt, wobei Wasserstoff als Reduktionsmittel verwendet wird.
Verwendungsmöglichkeiten von Methanol
Methanol hat ein breites Anwendungsspektrum in verschiedenen Branchen, darunter:
- Kraftstoff: Fahrzeuge, Generatoren und andere Industrieanlagen können Methanol als Kraftstoff verwenden.
- Lösungsmittel: Methanol ist ein ausgezeichnetes Lösungsmittel für viele Substanzen, darunter Harze, Farbstoffe und Öle. Hersteller verwenden Methanol zur Herstellung von Farben, Lacken und anderen Beschichtungen.
- Chemisches Zwischenprodukt: Wird als Rohstoff für die Herstellung von Formaldehyd, Essigsäure und anderen Chemikalien verwendet.
- Frostschutzmittel: Wird als Frostschutzmittel in Automobilkühlsystemen verwendet.
- Enteisungsmittel: Wird als Enteisungsmittel für Flugzeugtragflächen und Landebahnen von Flughäfen verwendet.
- Reiniger: Wird als Reinigungsmittel in verschiedenen industriellen Prozessen verwendet.
- Pharmazeutika: Wird als Lösungsmittel bei der Herstellung vieler pharmazeutischer Produkte verwendet.
- Alternative Energie: untersucht als alternativer Brennstoff für Brennstoffzellen und als potenzielles Energiespeichermedium.
- Methanol zu Olefinen (MTO): Olefine wie Ethylen und Propylen entstehen aus der Umwandlung von Methanol.
- Methanol zu Benzin (MTG): Ein Prozess namens MTG wandelt Methanol in Benzin um.
Fragen:
F: Was ist Methanol?
A: Methanol, auch Holzalkohol genannt, ist eine farblose, brennbare Flüssigkeit mit süßem Geruch. Es ist der einfachste Alkohol und seine chemische Formel ist CH3OH.
F: Ist Methanol polar oder unpolar?
A: Methanol ist ein polares Molekül. Es hat eine positive Teilladung an den Wasserstoffatomen und eine negative Teilladung am Sauerstoffatom, was zu einem Dipolmoment führt.
F: Wofür wird Methanol verwendet?
A: Methanol hat ein breites Anwendungsspektrum in verschiedenen Branchen, unter anderem als Kraftstoff, Lösungsmittel, chemisches Zwischenprodukt, Frostschutzmittel, Enteisungsmittel, Reiniger, pharmazeutisches Lösungsmittel und potenzielles Energiespeichermedium. Es wird auch bei der Herstellung von Formaldehyd, Essigsäure und anderen Chemikalien verwendet. Darüber hinaus wird Methanol in Olefine wie Ethylen und Propylen umgewandelt, die als Rohstoffe für die Herstellung von Kunststoffen verwendet werden.
