Calciumchlorid ist eine gut lösliche anorganische Verbindung mit der Formel CaCl2. Es wird häufig als Enteisungsmittel und Trockenmittel sowie bei der Herstellung von Kalziumsalzen und Chemikalien verwendet.
| IUPAC-Name | Calciumchlorid |
| Molekularformel | CaCl2 |
| CAS-Nummer | 10043-52-4 |
| Synonyme | Calciumdichlorid, Calcium(II)-chlorid |
| E509, Pökelsalz, Dowflake, Peladow, TETRA | |
| InChI | InChI=1S/Ca.2ClH/h;2*1H/q+2;;/p-2 |
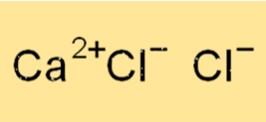
Calciumchlorid-Formel
Die chemische Formel für Calciumchlorid lautet CaCl2. Das bedeutet, dass jede Einheit Calciumchlorid aus einem Calciumion (Ca2+) und zwei Chloridionen (Cl-) besteht. Calciumchlorid ist eine ionische Verbindung, das heißt, es wird durch elektrostatische Anziehung zwischen dem positiv geladenen Calciumion und den negativ geladenen Chloridionen zusammengehalten.
Molmasse von Calciumchlorid
Calciumchlorid hat eine Molmasse von 110,98 g/mol, was der Summe der Atommassen eines Ca-Atoms und zweier Cl-Atome entspricht. Es handelt sich um eine anorganische Verbindung, die in Wasser gut löslich ist. Wasser und wird üblicherweise als Trocknungsmittel, Trockenmittel und Enteisungsmittel verwendet. Calciumchlorid wird auch bei der Herstellung von Calciumsalzen und anderen Chemikalien verwendet.
Siedepunkt von CaCl2
Der Siedepunkt von CaCl2 liegt bei 1935 °C, was für eine anorganische Verbindung sehr hoch ist. Dies ist auf die starken Ionenbindungen zwischen den Ca+2- und Cl–Ionen zurückzuführen, deren Aufbrechen viel Energie erfordert. CaCl2 ist eine hygroskopische Verbindung, das heißt, sie nimmt Feuchtigkeit aus der Luft auf und kann sich in Wasser zu einer hochkonzentrierten Lösung lösen.
Schmelzpunkt von CaCl2
CaCl2 hat einen Schmelzpunkt von 772 °C. Es hat eine kristalline Struktur und liegt meist in wasserfreier Form vor, das heißt, es enthält keine Wassermoleküle. Beim Erhitzen zerfällt CaCl2 in Calciumoxid und Chlorwasserstoffgas.
Dichte von CaCl2 g/ml
Die Dichte von CaCl2 hängt von der Konzentration der Lösung ab. Eine 1 M Lösung von CaCl2 hat eine Dichte von etwa 1,4 g/ml, während eine 3 M Lösung eine Dichte von etwa 1,6 g/ml hat. Die Dichte von festem CaCl2 beträgt 2,15 g/cm³.
Molekulargewicht von CaCl2
Das Molekulargewicht von CaCl2 beträgt 110,98 g/mol. Es ist eine anorganische Verbindung, die aus einem Ca-Atom und zwei Cl-Atomen besteht. CaCl2 ist bei Raumtemperatur ein weißer kristalliner Feststoff und in Wasser gut löslich.
Struktur von CaCl2
CaCl2 hat eine Kristallgitterstruktur, die durch ionische Bindungen zwischen dem Calciumkation (Ca2+) und dem Chloridanion (Cl-) zusammengehalten wird. Jedes Ca+2-Ion ist von sechs Cl–Ionen umgeben und jedes Chlorid-Ion ist von sechs Calciumionen umgeben. Die Kristallstruktur von CaCl2 ist kubisch, wobei jede Elementarzelle ein Calciumion und zwei Chloridionen enthält.
| Aussehen | Weißer Feststoff |
| Spezifisches Gewicht | 2,15 (fest), 1,4-1,6 (Lösung) |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 110,98 g/Mol |
| Dichte | 2,15 g/cm³ (fest), 1,4-1,6 g/cm³ (Lösung) |
| Fusionspunkt | 772°C |
| Siedepunkt | 1935°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr gut wasserlöslich |
| Löslichkeit | Löslich in Ethanol und Aceton |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | – |
| pH-Wert | 4,5–11,0 (10 %ige Lösung) |
Sicherheit und Gefahren von Calciumchlorid
CaCl2 kann Haut- und Augenreizungen verursachen und das Einatmen von Staub oder Nebel kann zu Reizungen der Atemwege führen. Bei Kontakt mit der Haut oder den Augen kann es außerdem zu Verbrennungen kommen. CaCl2 ist hygroskopisch, das heißt, es kann Feuchtigkeit aufnehmen und Wärme abgeben, was zum Platzen oder Explodieren von Behältern führen kann. Es wirkt außerdem korrosiv gegenüber bestimmten Metallen und kann mit bestimmten organischen Materialien reagieren. Beim Umgang mit CaCl2 sollte geeignete Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden. Verschüttete Flüssigkeiten sollten sofort beseitigt und die Behälter an einem kühlen, trockenen und gut belüfteten Ort gelagert werden.
| Gefahrensymbole | Ätzend, Reizend |
| Sicherheitsbeschreibung | Schutzhandschuhe und Augen-/Gesichtsschutz tragen. Staub/Rauch/Gas/Nebel/Dämpfe nicht einatmen. |
| UN-Identifikationsnummern | UN 3077, UN 1786 (Unze hydratisiert) |
| HS-Code | 2827.39.90 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | III |
| Toxizität | Die Toxizität ist bei den meisten Anwendungen gering, kann jedoch in großen Mengen gefährlich sein |
Methoden zur Synthese von Calciumchlorid
Zur Synthese von CaCl2 stehen mehrere Methoden zur Verfügung.
Eine Methode besteht darin, Calciumcarbonat oder Calciumhydroxid mit Salzsäure umzusetzen. Eine Methode besteht darin, der Salzsäure Calciumcarbonat oder Calciumhydroxid zuzusetzen. Die Lösung verdampft und ergibt CaCl2.
Eine andere Methode ist die Reaktion von Calciumoxid mit Salzsäure . Bei dieser Methode wird Salzsäure Calciumoxid zugesetzt und die Lösung anschließend eingedampft, um CaCl2 zu erhalten.
Eine dritte Methode beinhaltet die Reaktion von metallischem Kalzium mit Chlorgas . Eine weniger verbreitete Methode ist das Erhitzen von Calciummetall in Gegenwart von Chlorgas. Bei der Reaktion entsteht CaCl2, Experten verwenden diesen Ansatz jedoch aufgrund der hohen Reaktivität von Calciummetall und der Notwendigkeit einer speziellen Handhabung nicht häufig.
Um CaCl2 mit einer anderen Methode herzustellen, kann man das Nebenprodukt des Solvay-Prozesses verwenden, bei dem Natriumchlorid und CaCl2 erzeugt werden. Der Prozess beinhaltet die Extraktion von CaCl2 aus dem Nebenprodukt durch Filtrations-, Verdampfungs- und Reinigungstechniken. Diese Schritte tragen dazu bei, alle Verunreinigungen zu entfernen und hochreines CaCl2 zu erzeugen.
Verwendung von Calciumchlorid
CaCl2 hat viele industrielle Anwendungen:
- Wird als Trockenmittel zur Aufnahme von Feuchtigkeit, als Enteisungsmittel für Straßen und Gehwege und als Gerinnungsmittel bei der Herstellung von Tofu und anderen Lebensmitteln verwendet.
- Wird in der Öl- und Gasindustrie verwendet, um die Dichte von Bohrflüssigkeiten zu erhöhen und den Gefrierpunkt von Wasser in Rohrleitungen zu senken.
- Wird in Betonmischungen verwendet, um den Aushärtungsprozess zu beschleunigen und die Festigkeit und Haltbarkeit des Endprodukts zu erhöhen.
- Wird bei der Papierherstellung verwendet, um die Festigkeit und Stabilität von Papierfasern zu erhöhen.
- Wird bei der Wasseraufbereitung verwendet, um Verunreinigungen zu entfernen und Wasser zu enthärten.
- Wird als Quelle für Kalziumionen in medizinischen Anwendungen wie intravenösen Flüssigkeiten und zur Behandlung von Hypokalzämie verwendet.
- Wird bei der Herstellung von Kunststoffen und Gummi verwendet, um die Härte und Haltbarkeit des Endprodukts zu erhöhen.
- Wird bei der Konservierung von Obst und Gemüse verwendet, um den Verderb zu verhindern und die Textur und den Geschmack des Produkts zu erhalten.
- Wird in der Textilproduktion verwendet, um die Farbstoffaufnahme zu verbessern und die Faserfestigkeit und -flexibilität zu erhöhen.
- Wird auch bei der Herstellung von Feuerlöschern und als Bestandteil flammhemmender Materialien verwendet, um die Ausbreitung von Flammen zu verhindern.
Fragen:
F: Was ist Calciumchlorid?
A: Calciumchlorid ist eine chemische Verbindung bestehend aus Ca2+- und Cl–Ionen mit der chemischen Formel CaCl2.
F: Ist Calciumchlorid ionisch oder kovalent?
A: CaCl2 ist eine ionische Verbindung, da sie aus positiv geladenen Ca2+-Ionen und negativ geladenen Cl–Ionen besteht, die durch ionische Bindungen zusammengehalten werden.
F: Wofür wird Calciumchlorid verwendet?
A: CaCl2 hat viele industrielle, kommerzielle und medizinische Anwendungen, unter anderem als Trockenmittel, Enteisungsmittel, Gerinnungsmittel in der Lebensmittelproduktion, Beschleuniger in Beton, Wasserenthärter und Quelle von Kalziumionen bei medizinischen Behandlungen.
F: Wie lautet die Formel für Calciumchlorid?
A: Die Formel für Calciumchlorid lautet CaCl2, was bedeutet, dass jedes Molekül ein Calciumion und zwei Chloridionen enthält.
F: Ist CaCl2 ionisch oder kovalent?
A: CaCl2 ist eine ionische Verbindung, da sie aus positiv geladenen Calciumionen und negativ geladenen Chloridionen besteht, die durch ionische Bindungen zusammengehalten werden.
F: Ist CaCl2 wasserlöslich?
A: Ja, CaCl2 ist gut wasserlöslich, was bedeutet, dass es sich leicht in Wasser auflösen kann, um eine klare Lösung zu bilden.
F: Wenn CaCl2 in Wasser gelöst ist, was können wir dann über die Konzentration des Ca2+-Ions sagen?
A: Wenn CaCl2 in Wasser gelöst wird, zerfällt es in seine Ionenbestandteile Ca2+ und 2Cl-. Da CaCl2 in Wasser vollständig dissoziiert, ist die Konzentration an Ca2+-Ionen in Lösung doppelt so hoch wie die Konzentration von CaCl2.
