Magnesiumchlorid (MgCl2) ist eine Verbindung aus Magnesium- und Chloridionen. Es wird häufig als Ergänzung zur Behandlung von Magnesiummangel und als Enteisungsmittel für Straßen und Gehwege verwendet.
| IUPAC-Name | Magnesiumchlorid |
| Molekularformel | MgCl2 |
| CAS-Nummer | 7786-30-3 |
| Synonyme | Magnesiumdichlorid, Chlormagnesit, Bischlormagnesium, Magnesium(II)-chlorid, E511, Nigari |
| InChI | InChI=1S/2ClH.Mg/h2*1H;/q;;+2/p-2 |
Magnesiumchlorid-Formel
Die chemische Formel für Magnesiumchlorid lautet MgCl2. Diese Formel besagt, dass Magnesiumchlorid aus einem Mg+2-Ion und zwei Cl–Ionen besteht. Die Formel ist wichtig, um die Menge an Magnesiumchlorid zu bestimmen, die für chemische Reaktionen benötigt wird. Magnesiumchlorid wird häufig als Ergänzung zur Behandlung von Magnesiummangel und als Enteisungsmittel für Straßen und Gehwege verwendet.
Molmasse von Magnesiumchlorid
Die Molmasse von Magnesiumchlorid beträgt 95,21 g/mol. Es ist eine kristalline Verbindung, die aus einem Mg+2-Ion und zwei Cl–Ionen besteht. Die Molmasse ist eine wichtige Eigenschaft von Magnesiumchlorid, da sie zur Berechnung der Stoffmenge bei chemischen Reaktionen verwendet wird. Magnesiumchlorid wird häufig als Ergänzung zur Behandlung von Magnesiummangel und als Enteisungsmittel für Straßen und Gehwege verwendet.
Siedepunkt von MgCl2
MgCl2 hat einen hohen Siedepunkt von 1.412 °C, was bedeutet, dass es viel Energie benötigt, um die Bindungen zwischen seinen Atomen und Molekülen aufzubrechen. Diese Eigenschaft macht es bei Hochtemperaturanwendungen nützlich, beispielsweise bei der Herstellung von Metallen und Legierungen. MgCl2 wird auch als Trockenmittel zur Aufnahme von Feuchtigkeit aus der Luft und als Katalysator bei chemischen Reaktionen verwendet.
Schmelzpunkt von MgCl2
Der Schmelzpunkt von MgCl2 liegt bei 714 °C, was bedeutet, dass es bei Raumtemperatur ein Feststoff ist. Diese Eigenschaft macht es in verschiedenen Anwendungen nützlich, beispielsweise bei der Herstellung von Magnesiummetall und als Flussmittel beim Aluminiumschweißen. MgCl2 wird auch als Gerinnungsmittel bei der Herstellung von Tofu und anderen Sojaprodukten verwendet.
Dichte MgCl2 g/ml
Die Dichte von MgCl2 beträgt 2,32 g/ml. Diese Eigenschaft macht es für verschiedene Anwendungen nützlich, beispielsweise für die Herstellung flammhemmender Materialien und die Abwasserbehandlung. MgCl2 wird auch als Staubunterdrückungsmittel auf Straßen und im Autobahnbau eingesetzt.
Molekulargewicht von MgCl2
Das Molekulargewicht von MgCl2 beträgt 95,21 g/mol. Diese Eigenschaft ist wichtig für die Bestimmung der Menge an MgCl2, die für chemische Reaktionen benötigt wird. MgCl2 wird häufig als Ergänzung zur Behandlung von Magnesiummangel und als Enteisungsmittel für Straßen und Gehwege verwendet.
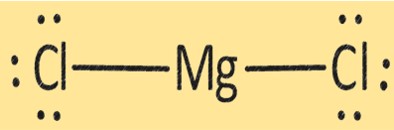
MgCl2-Struktur
MgCl2 hat eine Kristallstruktur, die aus einem Mg+2-Ion und zwei Cl–Ionen besteht. Die Struktur von MgCl2 ist wichtig für die Bestimmung seiner physikalischen und chemischen Eigenschaften. MgCl2 wird in verschiedenen Anwendungen verwendet, beispielsweise bei der Herstellung von Magnesiummetall, als Trockenmittel und als Gerinnungsmittel bei der Herstellung von Tofu und anderen Sojaprodukten.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2,32 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 95,21 g/Mol |
| Dichte | 2,32 g/ml |
| Fusionspunkt | 714°C |
| Siedepunkt | 1412°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Wasser, Ethanol, Methanol |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | 7,6 (für Mg(H2O)6^2+ Ionen) |
| pH-Wert | 6,0 – 8,0 |
Sicherheit und Gefahren von Magnesiumchlorid
Magnesiumchlorid (MgCl2) gilt bei bestimmungsgemäßer Verwendung im Allgemeinen als sicher. Allerdings kann es bei unsachgemäßer Handhabung einige Gefahren bergen. Es kann zu Reizungen der Haut und der Augen führen und das Einatmen von Staub kann Atemprobleme verursachen. Die Einnahme großer Mengen MgCl2 kann Übelkeit, Erbrechen und Durchfall verursachen. Es kann auch schädlich für Wasserlebewesen sein, wenn es in Gewässer gelangt. Beim Umgang mit MgCl2 sollte geeignete Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden. Eventuelle Verschüttungen oder Freisetzungen müssen sofort eingedämmt und beseitigt werden, um Umweltschäden zu vermeiden.
| Gefahrensymbole | Keine zugewiesen |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. Bei Kontakt mit Wasser abspülen. Tragen Sie beim Umgang Handschuhe und Schutzbrille. |
| UN-Identifikationsnummern | EIN 2019 |
| HS-Code | 28273100 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | III |
| Toxizität | LD50 (oral, Ratte) – 4.640 mg/kg; LC50 (Inhalation, Ratte) – >4,4 mg/L für 4 Stunden |
Methoden zur Magnesiumchlorid-Synthese
Verschiedene Methoden können MgCl2 synthetisieren, einschließlich der Direktsynthese, der Reaktion mit Salzsäure und der Reaktion mit MgO.
Um MgCl2 durch Direktsynthese herzustellen, verbrennen Sie Magnesiummetall in Luft oder Chlorgas, um MgO zu erzeugen. Als nächstes reagieren Sie MgO mit Salzsäure, um MgCl2 herzustellen:
Mg + O2 → MgO
MgO + 2HCl → MgCl2 + H2O
Eine andere Methode besteht darin, metallisches Mg mit Salzsäure zu reagieren, um MgCl2 und Wasserstoffgas zu erzeugen:
Mg + 2HCl → MgCl2 + H2
Für die Reaktion mit MgO mischen wir MgO mit Salzsäure , um MgCl2 und Wasser herzustellen:
MgO + 2HCl → MgCl2 + H2O
Beim Mischen von MgO mit Salzsäure entstehen bei der Reaktion mit MgO Magnesiumchlorid und Wasser:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Darüber hinaus können wir MgCl2 als Nebenprodukt des Solvay-Prozesses erhalten, bei dem Natriumcarbonat entsteht. Bei diesem Prozess entstehen als Nebenprodukte Calciumchlorid und MgCl2, die von der Natriumcarbonatlösung abgetrennt werden können.
Verwendung von Magnesiumchlorid
Magnesiumchlorid hat vielfältige Einsatzmöglichkeiten in verschiedenen Branchen, darunter:
- Enteisungsmittel: Wird in den Wintermonaten als Enteisungsmittel auf Straßen und Gehwegen verwendet, da es den Gefrierpunkt von Wasser senken kann.
- Staubkontrolle: Wird als Staubkontrollmittel auf unbefestigten Straßen und Baustellen verwendet.
- Lebensmittelindustrie: Wird als Gerinnungsmittel bei der Herstellung von Tofu und als Magnesiumquelle in bestimmten Lebensmitteln verwendet.
- Medizin: Wird medizinisch als Ergänzung bei Magnesiummangel und zur Behandlung bestimmter Erkrankungen wie Verstopfung und Sodbrennen verwendet.
- Landwirtschaft: Wird als Dünger und Bodenverbesserer verwendet, um den Magnesiumgehalt des Bodens und das Pflanzenwachstum zu verbessern.
- Wasseraufbereitung: Wird in Wasseraufbereitungsprozessen verwendet, um Verunreinigungen zu entfernen und hartes Wasser zu erweichen.
- Industrielle Anwendungen: Wird bei der Herstellung von Textilien, Papier und Zement sowie in verschiedenen industriellen Prozessen verwendet.
- Gesundheit und Wellness: Wird bei verschiedenen Gesundheits- und Wellnesspraktiken wie dem Baden verwendet, um die Entspannung zu fördern und die Gesundheit der Haut zu verbessern.
Fragen:
F: Wie lautet die Formel für Magnesiumchlorid?
A: Die Formel für Magnesiumchlorid lautet MgCl2.
F: Was ist Magnesiumchlorid?
A: MgCl2 ist eine anorganische Verbindung, die häufig in verschiedenen Branchen und Anwendungen verwendet wird, unter anderem als Enteisungsmittel, Staubbekämpfungsmittel und Lebensmittelzusatzstoff.
F: Ist Magnesiumchlorid löslich?
A: Ja, MgCl2 ist in Wasser und anderen polaren Lösungsmitteln löslich.
F: Ist Magnesiumchlorid ionisch oder kovalent?
A: MgCl2 ist eine ionische Verbindung, die aus einem Kation (Mg2+) und einem Anion (Cl-) besteht.
F: Was ist MgCl2?
A: MgCl2 ist die chemische Formel für Magnesiumchlorid, eine anorganische Verbindung, die in verschiedenen Industrie- und Verbraucheranwendungen verwendet wird.
F: Wie lautet die Nettoionengleichung für die Reaktion von MgCl2 mit NaOH?
A: Die Nettoionengleichung für die Reaktion von MgCl2 mit NaOH lautet Mg2+ (aq) + 2OH- (aq) → Mg(OH)2 (s).
