Calciumnitrat ist eine chemische Verbindung mit der Formel Ca(NO3)2. Es ist ein farb- und geruchloser Feststoff, der in Wasser sehr gut löslich ist. Calciumnitrat wird häufig als Düngemittel und in der Abwasserbehandlung verwendet. Es wird auch bei der Herstellung von Beton, als Bestandteil von Sprengstoffen und bei der Herstellung verschiedener anderer Chemikalien verwendet.
| IUPAC-Name | Calciumdinitrat |
| Molekularformel | Ca(NO3)2 |
| CAS-Nummer | 10124-37-5 |
| Synonyme | Calciumnitrat-Tetrahydrat, Calciumsalz der Salpetersäure, Nitrocalcit, Norwegischer Salpeter, Kalksalpeter, Norgessalpeter |
| InChI | InChI=1S/Ca.2NO3/c;22-1(3)4/q+2;2-1 |
Calciumnitrat-Formel
Die Formel für Calciumnitrat lautet Ca(NO3)2. Das bedeutet, dass jede Einheit Calciumnitrat ein Calciumion (Ca²⁺) und zwei Nitrationen (NO3⁻) enthält. Die Calciumnitratformel wird häufig zur Bestimmung der Molmasse und anderer Eigenschaften der Verbindung verwendet.
Molmasse von Calciumnitrat
Calciumnitrat hat eine Molmasse von 164.088 g/mol. Es ist ein Salz bestehend aus Ca+2- und NO3–Ionen mit der Formel Ca(NO3)2. Die Molmasse einer Verbindung ist die Masse in Gramm eines Mols dieser Formelverbindung, die ihrem Gewicht entspricht. Im Fall von Ca(NO3)2 ist das Formelgewicht die Summe der Atomgewichte aller Atome in der Verbindung.
Siedepunkt von Calciumnitrat
Ca(NO3)2 hat einen relativ hohen Siedepunkt von 132 Grad Celsius. Das bedeutet, dass eine erhebliche Energiemenge erforderlich ist, um die feste Verbindung in ein Gas umzuwandeln. Der hohe Siedepunkt von Ca(NO3)2 ist auf seinen ionischen Charakter zurückzuführen, der zu starken elektrostatischen Wechselwirkungen zwischen Ca+2- und NO3–Ionen führt.
Schmelzpunkt von Calciumnitrat
Der Schmelzpunkt von Ca(NO3)2 liegt bei 561 Grad Celsius. Dies ist für ein Salz relativ hoch und spiegelt erneut die starken ionischen Wechselwirkungen zwischen Ca+2- und NO3–Ionen wider. Der Schmelzpunkt von Ca(NO3)2 macht es zu einer nützlichen Verbindung für Hochtemperaturanwendungen, beispielsweise bei der Herstellung von Düngemitteln oder Sprengstoffen.
Dichte von Calciumnitrat g/ml
Die Dichte von Ca(NO3)2 variiert je nach Form. Beispielsweise beträgt die Dichte von wasserfreiem Ca(NO3)2 etwa 2,5 g/cm³, während die Dichte von Tetrahydrat (Ca(NO3)2.4H2O) etwa 1,82 g/cm³ beträgt. Diese Werte machen Ca(NO3)2 im Vergleich zu vielen anderen Salzen zu einer relativ dichten Verbindung.
Molekulargewicht von Calciumnitrat
Das Molekulargewicht von Ca(NO3)2 beträgt 164,088 g/mol. Dieser Wert ist die Summe der Atomgewichte aller Atome in der Verbindung, darunter zwei Stickstoffatome, sechs Sauerstoffatome und ein Calciumatom.
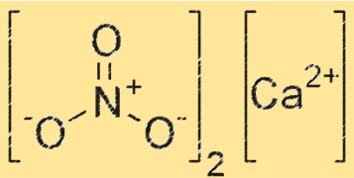
Struktur von Calciumnitrat
Ca(NO3)2 hat eine ionische Struktur, wobei das Calciumion (Ca²⁺) von sechs Sauerstoffatomen in oktaedrischer Anordnung umgeben ist. Das NO3–Ion ist auch im Kristallgitter vorhanden, wobei jedes Sauerstoffatom des NO3–Ions eine Koordinationsbindung mit dem Ca+2-Ion eingeht. Die Struktur von Ca(NO3)2 ähnelt der anderer ionischer Verbindungen, beispielsweise Natriumchlorid.
| Aussehen | Weiße Kristalle oder Pulver |
| Spezifisches Gewicht | 2,5 (wasserfrei); 1,82 (Tetrahydrat) |
| Farbe | Farblos (wasserfrei); Weiß (Tetrahydrat) |
| Geruch | Geruchlos |
| Molmasse | 164.088 g/Mol |
| Dichte | 2,5 g/cm³ (wasserfrei); 1,82 g/cm³ (Tetrahydrat) |
| Fusionspunkt | 561°C (wasserfrei); 45°C (Tetrahydrat) |
| Siedepunkt | 132°C (zersetzt sich) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 121,2 g/100 ml (0 °C); 126,7 g/100 ml (20 °C); 179,6 g/100 ml (100 °C) |
| Löslichkeit | Löslich in Wasser, Ethanol, Methanol |
| Dampfdruck | Vernachlässigbar (wasserfrei) |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | 4,5–7,5 (10 %ige Lösung) |
Sicherheit und Gefahren von Calciumnitrat
Calciumnitrat (Ca(NO3)2) kann bei unsachgemäßer Handhabung mehrere Gefahren bergen. Es ist ein starkes Oxidationsmittel, das bei Kontakt mit brennbaren Materialien einen Brand oder eine Explosion verursachen kann. Die Verbindung kann bei Kontakt auch Haut- und Augenreizungen verursachen, und das Einatmen von Staub kann zu Reizungen der Atemwege führen. Ca(NO3)2 sollte an einem kühlen, trockenen Ort fern von Wärmequellen gelagert werden und nicht ohne entsprechende Vorsichtsmaßnahmen mit anderen Chemikalien gemischt werden. Beim Umgang mit Ca(NO3)2 sollte persönliche Schutzausrüstung wie Handschuhe und Augenschutz getragen werden, um Haut- oder Augenkontakt zu vermeiden. Im Falle einer versehentlichen Einnahme sollte sofort ein Arzt aufgesucht werden.
| Gefahrensymbole | Oxidationsmittel (GHS05), Reizend (GHS07) |
| Sicherheitsbeschreibung | S22: Staub/Rauch/Gas/Nebel/Dämpfe/Aerosole nicht einatmen. S26: Bei Augenkontakt sofort mit viel Wasser ausspülen und einen Arzt aufsuchen. S36/37/39: Geeignete Schutzkleidung, Handschuhe und Augen-/Gesichtsschutz tragen. |
| AN-Kennungen | UN1454 (Calciumnitrat wasserfrei), UN1455 (Calciumnitrat-Tetrahydrat) |
| HS-Code | 283429 |
| Gefahrenklasse | 5.1 (Oxidationsmittel) |
| Verpackungsgruppe | III |
| Toxizität | Oral (LD50): 3.420 mg/kg (Ratte); Dermal (LD50): > 5.000 mg/kg (Kaninchen); Inhalation (LC50): >4,8 mg/l/4h (Ratte) |
Methoden zur Calciumnitrat-Synthese
Abhängig von der spezifischen Anwendung und der gewünschten Reinheit gibt es verschiedene Methoden zur Synthese von Ca(NO3)2.
Eine gängige Methode ist die Reaktion von Calciumcarbonat mit Salpetersäure zur Bildung von Ca(NO3)2 und Kohlendioxid:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
Eine andere Methode besteht darin, Calciumhydroxid mit Salpetersäure umzusetzen:
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
Die Reaktion zwischen Salpetersäure und Calciumoxid ergibt Ca(NO3)2:
CaO + 2HNO3 → Ca(NO3)2 + H2O
Das resultierende Ca(NO3)2 kann durch Umkristallisation oder durch Zugabe einer kleinen Menge Schwefelsäure weiter gereinigt werden, um Verunreinigungen wie Eisen und Aluminium zu entfernen.
Hersteller können Ca(NO3)2 durch die Reaktion von Calciummetall mit Salpetersäure oder durch die Reaktion von Calciumhydroxid mit Ammoniumnitrat herstellen. Aufgrund der höheren Kosten oder Sicherheitsbedenken im Zusammenhang mit reaktiven Metallen oder Ammoniumnitrat werden diese Methoden jedoch seltener eingesetzt.
Verwendung von Calciumnitrat
- Wird in der Landwirtschaft als Dünger verwendet, um Pflanzen mit Kalzium- und Stickstoffnährstoffen für das Wachstum zu versorgen.
- Wird als Bestandteil verschiedener Beton- und Zementarten verwendet, um deren Festigkeit und Haltbarkeit zu verbessern.
- Wird als Zusatzstoff bei der Herstellung von Abwasserbehandlungschemikalien verwendet, um Phosphor- und Stickstoffverbindungen aus Wasser zu entfernen.
- Wird aufgrund seiner oxidierenden Eigenschaften bei der Herstellung verschiedener Arten von Sprengstoffen und Feuerwerkskörpern verwendet.
- Wird als Kalzium- und Stickstoffquelle bei der Herstellung verschiedener Chemikalien wie Nylon und anderen synthetischen Fasern verwendet.
- Wird als Korrosionsinhibitor für Metalle wie Aluminium und Stahl in industriellen Anwendungen verwendet.
- Wird zur Fleischkonservierung und als Lebensmittelzusatzstoff zur Verbesserung der Qualität bestimmter Lebensmittelprodukte verwendet.
- Wird zur Herstellung von Rauchbomben und Leuchtraketen für militärische und zivile Zwecke verwendet.
- Wird bei der Herstellung bestimmter Düngemittel verwendet. Wird auch in Kombination mit anderen Verbindungen verwendet, um eine ausgewogene Nährstoffversorgung der Pflanzen sicherzustellen.
- Wird als Bestandteil einiger Spezialdünger für Aquarien verwendet, um Wasserpflanzen mit wichtigen Nährstoffen zu versorgen.
Fragen:
F: Wie heißt Ca(NO3)2?
A: Der Name von Ca(NO3)2 ist Calciumnitrat.
F: Ist Ca(NO3)2 wasserlöslich?
A: Ja, Ca(NO3)2 ist in Wasser gut löslich. Bei Raumtemperatur können 100 Gramm Wasser bis zu 121 Gramm Calciumnitrat lösen.
F: Wo kann man Calciumnitrat kaufen?
A: Ca(NO3)2 kann bei verschiedenen Chemielieferanten, online und im Handel erworben werden. Zu den üblichen Orten, an denen Ca(NO3)2 gekauft wird, gehören wissenschaftliche Versorgungsunternehmen, landwirtschaftliche Fachgeschäfte sowie Haus- und Gartencenter. Es ist wichtig sicherzustellen, dass der Lieferant seriös ist und das Produkt von hoher Qualität und für die beabsichtigte Anwendung geeignet ist.
