Magnesiumnitrat ist eine weiße kristalline Verbindung mit der chemischen Formel Mg(NO3)2. Aufgrund seiner hohen Reaktivität und oxidierenden Eigenschaften wird es bei der Herstellung von Düngemitteln, Sprengstoffen und pyrotechnischen Produkten eingesetzt.
| IUPAC-Name | Magnesiumdinitrat |
| Molekularformel | Mg(NO3)2 |
| CAS-Nummer | 10377-60-3 |
| Synonyme | Salpetersäure, Magnesiumsalz; UN 1474; Magnesiumnitrat (II); Magnesiumsalz der Salpetersäure (2+) |
| InChI | InChI=1S/Mg.2NO3/c;22-1(3)4/q+2;2-1 |
Magnesiumnitrat-Formel
Die chemische Formel für Magnesiumnitrat lautet Mg(NO3)2, was darauf hinweist, dass die Verbindung ein Magnesiumkation (Mg²⁺) und zwei Nitratanionen (NO₃⁻) enthält. Diese Formel wird verwendet, um die Stöchiometrie der Verbindung in chemischen Gleichungen darzustellen und wird auch zur Bestimmung des Molekulargewichts und anderer Eigenschaften von Magnesiumnitrat verwendet.
Molmasse von Magnesiumnitrat
Die Molmasse von Magnesiumnitrat, die durch die chemische Formel Mg(NO3)2 dargestellt wird, beträgt etwa 148,31 g/mol. Dieser Wert kann durch Addition der in der Verbindung vorhandenen Atommassen von Magnesium (24,31 g/mol), zwei Stickstoffatomen (je 28,02 g/mol) und sechs Sauerstoffatomen (je 16,00 g/mol) berechnet werden. Die Kenntnis der Molmasse ist entscheidend für die Bestimmung der Menge an Magnesiumnitrat, die für chemische Reaktionen oder die Herstellung von Lösungen benötigt wird.
Siedepunkt von Magnesiumnitrat
Mg(NO3)2 hat einen relativ hohen Siedepunkt von etwa 330 °C (626 °F) bei Atmosphärendruck. Dieser Wert kann je nach Reinheit und Konzentration der Verbindung leicht variieren. Der Siedepunkt von Mg(NO3)2 ist in industriellen Prozessen zur Herstellung von Düngemitteln, Sprengstoffen und Pyrotechnik sowie in Laborexperimenten von Bedeutung.
Schmelzpunkt von Magnesiumnitrat
Der Schmelzpunkt von Mg(NO3)2, also die Temperatur, bei der die feste Verbindung in einen flüssigen Zustand übergeht, beträgt etwa 89 °C (192 °F) für die wasserfreie Form und 95 °C (203 °F) für die wasserfreie Form. hexahydratisierte Form. Aufgrund seiner Stabilität und einfachen Handhabung wird häufiger die Hexahydratform von Mg(NO3)2 verwendet. Der Schmelzpunkt ist eine wesentliche physikalische Eigenschaft, die zur Bestimmung der Reinheit von Mg(NO3)2 sowie in verschiedenen industriellen Prozessen verwendet wird.
Dichte von Magnesiumnitrat g/ml
Die Dichte von Mg(NO3)2 variiert je nach Form der Verbindung. Die wasserfreie Form hat eine Dichte von etwa 2,3 g/cm³, während die Hexahydratform eine Dichte von etwa 1,46 g/cm³ hat. Die Dichte von Mg(NO3)2 ist ein entscheidender Faktor für die Bestimmung des Volumens der Verbindung, das bei chemischen Reaktionen sowie für deren Lagerung und Transport benötigt wird.
Molekulargewicht von Magnesiumnitrat
Das Molekulargewicht von Mg(NO3)2, das die Summe der Atomgewichte aller Elemente in der Verbindung darstellt, beträgt etwa 148,31 g/mol. Dieser Wert ist bei verschiedenen chemischen Berechnungen wichtig, insbesondere um die Menge an Mg(NO3)2 zu bestimmen, die bei Reaktionen oder bei der Herstellung von Lösungen benötigt wird.
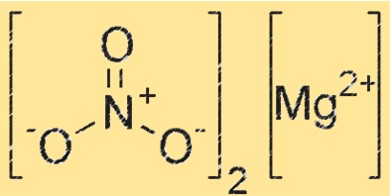
Struktur von Magnesiumnitrat
Mg(NO3)2 hat eine Kristallstruktur, die zum orthorhombischen Kristallsystem gehört. Die Verbindung besteht aus Magnesiumkationen (Mg²⁺) und Nitratanionen (NO₃⁻), wobei jedes Magnesiumkation von sechs Nitratanionen in oktaedrischer Anordnung umgeben ist. Die Kristallstruktur von Mg(NO3)2 spielt eine entscheidende Rolle für seine Reaktivität und Eigenschaften.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 2,3 (wasserfrei), 1,46 (Hexahydrat) |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 148,31 g/Mol |
| Dichte | 2,3 g/cm³ (wasserfrei), 1,46 g/cm³ (Hexahydrat) |
| Fusionspunkt | 89°C (wasserfrei), 95°C (Hexahydrat) |
| Siedepunkt | 330°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 234 g/L (wasserfrei), 156 g/L (Hexahydrat) bei 20 °C |
| Löslichkeit | Löslich in Wasser, Ethanol, Methanol |
| Dampfdruck | 0,000009 mmHg bei 20 °C |
| Wasserdampfdichte | Unzutreffend |
| pKa | 1.8 |
| pH-Wert | 4,5–6,0 (5 %ige Lösung) |
Sicherheit und Gefahren von Magnesiumnitrat
Mg(NO3)2 kann bei unsachgemäßer Handhabung verschiedene Sicherheitsrisiken bergen. Bei Kontakt oder Einatmen kann es zu Reizungen und Verbrennungen an Haut, Augen und Atemwegen kommen. Die Verbindung ist außerdem ein starkes Oxidationsmittel und kann heftig mit organischen Materialien, einschließlich entflammbaren und brennbaren Substanzen, reagieren. Das Einatmen von Mg(NO3)2-Staub kann zu Atemwegsreizungen und sogar Lungenschäden führen. Lagern und handhaben Sie Mg(NO3)2 an einem kühlen, trockenen und gut belüfteten Ort, entfernt von Zündquellen. Verwenden Sie beim Umgang mit dieser Verbindung geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille.
| Gefahrensymbole | Oxidationsmittel |
| Sicherheitsbeschreibung | Kontakt mit brennbaren Materialien vermeiden. Tragen Sie persönliche Schutzausrüstung. Von Zündquellen fernhalten. |
| AN-Kennungen | UN 1474 |
| HS-Code | 283429 |
| Gefahrenklasse | 5.1 (Oxidationsmittel) |
| Verpackungsgruppe | II |
| Toxizität | LD50 (oral, Ratte): 3.500 mg/kg; LD50 (kutan, Kaninchen): > 2000 mg/kg. Magnesiumnitrat gilt nicht als krebserregend, mutagen oder teratogen. |
Methoden zur Magnesiumnitrat-Synthese
Magnesiumnitrat (Mg(NO3)2) kann durch verschiedene Methoden synthetisiert werden, einschließlich der Reaktion von Magnesiumoxid oder Magnesiumhydroxid mit Salpetersäure.
Eine Methode besteht darin, Magnesiumoxid zu einer Salpetersäurelösung in einem Kolben zu geben und die Mischung dann vorsichtig zu erhitzen, bis sie sich auflöst. Um die Mg(NO3)2-Kristalle zu erhalten, filtrieren Sie die Lösung, um Verunreinigungen zu entfernen, und verdampfen Sie das Lösungsmittel.
Eine andere Synthesemethode beinhaltet die Reaktion von Magnesiummetall mit Salpetersäure . Fügen Sie der Säure Magnesiumstreifen hinzu und lassen Sie die Reaktion weiterlaufen, bis sich das gesamte Metall aufgelöst hat. Dann verdampfen Sie die erhaltene Lösung, um die Mg(NO3)2-Kristalle zu erhalten.
Magnesiumcarbonat in Salpetersäure auflösen, um Mg(NO3)2 und Kohlendioxid zu bilden. Filtern Sie die resultierende Lösung und verdampfen Sie sie, um Mg(NO3)2-Kristalle zu erhalten.
Eine andere Methode besteht darin, Magnesiumhydroxid mit Salpetersäure zu Mg(NO3)2 und Wasser umzusetzen. Die erhaltene Lösung wird dann durch Filtration und Eindampfen gereinigt, um Mg(NO3)2-Kristalle zu erhalten.
Verwendung von Magnesiumnitrat
Magnesiumnitrat findet vielfältige Einsatzmöglichkeiten in verschiedenen Branchen und Anwendungen. Einige der Hauptanwendungen von Mg(NO3)2 sind:
- Landwirtschaft: Wird als Dünger verwendet, insbesondere für Nutzpflanzen, die einen hohen Magnesiumbedarf haben, wie Tomaten, Paprika und Zitrusfrüchte. Es hilft, das Pflanzenwachstum zu verbessern und die Erntequalität und den Ertrag zu verbessern.
- Pyrotechnische Produkte: Wird als Oxidationsmittel in Feuerwerkskörpern und anderen pyrotechnischen Anwendungen verwendet, da es helle, intensive Flammen erzeugen und dabei helfen kann, die Abbrandgeschwindigkeit zu kontrollieren.
- Glasproduktion: Wird als Flussmittel bei der Glasproduktion verwendet, um den Schmelzpunkt von Glas zu senken und seine Fließeigenschaften zu verbessern.
- Chemische Synthese: Wird als Reagenz bei verschiedenen chemischen Synthesereaktionen verwendet, beispielsweise bei der Herstellung anderer Magnesiumverbindungen, Katalysatoren und Arzneimittel.
- Konservierung: Wird als Lebensmittelkonservierungsmittel verwendet, um das Wachstum von Bakterien und anderen Mikroorganismen zu hemmen.
- Industrielle Anwendungen: Verwendung bei der Herstellung von Magnesiumoxid und Magnesiumhydroxid, die als Flammschutzmittel verwendet werden, bei der Abwasserbehandlung und als Neutralisierungsmittel in sauren Böden.
- Laborforschung: Wird in verschiedenen Laborexperimenten und Forschungsarbeiten verwendet, z. B. bei der Herstellung von Standardlösungen und beim Testen analytischer Verfahren.
Fragen:
F: Ist Mg(NO3)2 löslich?
A: Ja, Magnesiumnitrat ist in Wasser sehr gut löslich.
F: Wie lautet die Formel für Magnesiumnitrat?
A: Die Formel für Magnesiumnitrat lautet Mg(NO3)2.
F: Wie groß ist die Molmasse von Mg(NO3)2?
A: Die Molmasse von Mg(NO3)2 beträgt 148,31 g/mol.
F: Wie hoch ist das Formelgewicht von Mg(NO3)2?
A: Das Formelgewicht von Mg(NO3)2 beträgt 148,31 g/mol.
F: Wie lautet der systematische Name von Mg(NO3)2?
A: Der systematische Name für Mg(NO3)2 ist Magnesiumdinitrat.
F: Wie hoch ist die Konzentration an Nitrationen in einer 0,125 M Mg(NO3)2-Lösung?
A: Die Konzentration an Nitrationen in einer 0,125 M Mg(NO3)2-Lösung beträgt 0,25 M, da auf jedes Magnesiumion zwei Nitrationen kommen.
F: Wie lautet die Formelmasse von Mg(NO3)2?
A: Die Formelmasse von Mg(NO3)2 beträgt 148,31 g/mol.
