Kaliumchlorid (KCl) ist eine Verbindung, die Kalium und Chlor enthält. Es wird als Dünger, Lebensmittelzusatzstoff und zur medizinischen Behandlung bei niedrigem Kaliumspiegel verwendet. Es kann auch bei tödlichen Injektionen verwendet werden.
| IUPAC-Name | Kaliumchlorid |
| Molekularformel | KCl |
| CAS-Nummer | 7447-40-7 |
| Synonyme | KCl, Kalium Chloratum, Kalisalz, Sylvit, Chloropotassuril, Kalitabs, Klotrix, Klor-Con, K-Dur |
| InChI | InChI=1S/ClH.K/h1H;/q;+1/p-1 |
Kaliumchlorid-Formel
Die chemische Formel für Kaliumchlorid lautet KCl. Es ist eine binäre Verbindung, die aus einem Kaliumatom und einem Chloratom besteht. Die Formel von Kaliumchlorid ist wichtig für das Verständnis seiner chemischen Eigenschaften und für die Durchführung von Berechnungen im Zusammenhang mit seiner Verwendung in verschiedenen Anwendungen.
Molmasse von Kaliumchlorid
Die Molmasse von KCl beträgt 74,55 g/mol. Es ist ein weißer kristalliner Feststoff mit salzigem Geschmack und gut wasserlöslich. KCl ist eine Verbindung, die aus einem Kaliumatom und einem Chloratom besteht.
Siedepunkt von Kaliumchlorid
Der Siedepunkt von KCl beträgt 1.420 °C (2.588 °F). Es handelt sich um eine Verbindung mit hohem Schmelzpunkt, die erhebliche Energie benötigt, um ihren Siedepunkt zu erreichen. Der hohe Siedepunkt von KCl macht es für Hochtemperaturanwendungen nützlich, beispielsweise in der Keramik- und Glasproduktion.
Schmelzpunkt von KCl
Der Schmelzpunkt von KCl beträgt 770 °C (1.418 °F). Es handelt sich um eine Verbindung mit relativ hohem Schmelzpunkt, deren Schmelzen erhebliche Wärme erfordert. KCl wird in der Düngemittelproduktion verwendet und sein hoher Schmelzpunkt sorgt für seine Stabilität bei hohen Temperaturen.
KCl-Dichte g/ml
Die Dichte von KCl beträgt 1,98 g/cm³. Es handelt sich um eine relativ dichte Verbindung, das heißt, eine kleine Menge enthält eine große Anzahl an Partikeln. Die hohe Dichte von KCl macht es für bestimmte industrielle Anwendungen nützlich, beispielsweise bei der Herstellung von Bohrflüssigkeiten.
Molekulargewicht von KCl
Das Molekulargewicht von KCl beträgt 74,55 g/mol. Es handelt sich um eine relativ leichte Verbindung, das heißt, sie enthält eine geringe Anzahl an Partikeln. Das niedrige Molekulargewicht von KCl erleichtert den Transport und die Handhabung in industriellen Umgebungen.
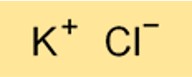
KCl-Struktur
Die Struktur von KCl ist ein ionisches Kristallgitter. Es besteht aus abwechselnden Kalium- und Chlorionen, die in einem sich wiederholenden Muster angeordnet sind. Aufgrund der ionischen Natur der Struktur ist KCl in Wasser gelöst ein guter Stromleiter.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 1,98 g/cm³ |
| Farbe | Farblos bis weiß |
| Geruch | Geruchlos |
| Molmasse | 74,55 g/Mol |
| Dichte | 1,98 g/cm³ |
| Fusionspunkt | 770 °C (1.418 °F) |
| Siedepunkt | 1420 °C (2588 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 34,7g/100ml (0°C) |
| Löslichkeit | Löslich in Wasser, Glycerin und Formamid; in Ethanol schwer löslich |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | -1,8 (konjugierte Säure) |
| pH-Wert | 7 (10 %ige Lösung) |
Sicherheit und Gefahren von Kaliumchlorid
Kaliumchlorid (KCl) birgt potenzielle Gefahren und Sicherheitsbedenken, die bei der Handhabung oder Verwendung berücksichtigt werden sollten. Dies kann zu Haut- und Augenreizungen führen und eine längere Exposition kann zu Verätzungen führen. Das Einatmen von KCl-Staub kann zu Reizungen der Atemwege und Husten führen. Darüber hinaus kann die Einnahme großer Mengen KCl zu Elektrolytstörungen und Herzrhythmusstörungen führen. Es ist wichtig, geeignete persönliche Schutzausrüstung wie Handschuhe und Augenschutz zu tragen und KCl in einem gut belüfteten Bereich zu handhaben. Bei Haut- oder Augenkontakt ist es wichtig, die betroffene Stelle gründlich zu spülen und gegebenenfalls einen Arzt aufzusuchen.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Verursacht Haut- und Augenreizungen. Gesundheitsschädlich beim Verschlucken. |
| EINE ID | UN1480 |
| HS-Code | 310420 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | LD50 (Ratte, oral): 2.500 mg/kg |
Methoden zur Kaliumchlorid-Synthese
Zur Synthese von Kaliumchlorid (KCl) gibt es mehrere Methoden, darunter:
- Solubilisierung und Kristallisation: Bei dieser Methode löst man KCl in Wasser und lässt die Lösung dann verdampfen, wobei feste KCl-Kristalle zurückbleiben.
- Ionenaustausch: Um KCl herzustellen, können Ionen in einer Lösung eines anderen Salzes, beispielsweise Natriumchlorid, durch Kaliumionen ausgetauscht werden. In der Industrie wird diese Methode üblicherweise bei der Herstellung von KCl-Düngemitteln eingesetzt.
- Elektrolyse: Durch die Elektrolyse einer KCl-Lösung entstehen elementares Kalium und Chlorgas, die sich zu KCl verbinden.
- Reaktion von Kaliumhydroxid mit Salzsäure : Kaliumhydroxid kann mit Salzsäure unter Bildung von KCl und Wasser reagieren.
- Reaktion von Kaliumcarbonat mit Salzsäure: Kaliumcarbonat kann mit Salzsäure unter Bildung von KCl, Kohlendioxid und Wasser reagieren.
Jede Methode hat ihre eigenen Vor- und Nachteile, und die Wahl der Methode kann von Faktoren wie der erforderlichen Reinheit des Produkts, dem Produktionsumfang und den Kosten für Rohstoffe und Ausrüstung abhängen.
Verwendung von Kaliumchlorid
Kaliumchlorid hat ein breites Anwendungsspektrum, darunter:
- Dünger: Wird als Dünger verwendet, um wichtige Nährstoffe für das Pflanzenwachstum bereitzustellen.
- Lebensmittelzusatzstoff: Wird als Ersatz für Salz in verarbeiteten Lebensmitteln verwendet, um die Natriumaufnahme zu reduzieren.
- Wasseraufbereitung: Wird Wasseraufbereitungssystemen hinzugefügt, um Korrosion und Kalkbildung zu verhindern.
- Medizinische Anwendungen: Wird in intravenösen Flüssigkeiten und oralen Rehydrierungslösungen verwendet, um Elektrolyte zu ersetzen und Erkrankungen wie Hypokaliämie zu behandeln.
- Industrielle Anwendungen: Verwendung bei der Herstellung von Glas, Keramik und Seifen sowie als Rohstoff bei der Herstellung anderer Chemikalien.
- Tierfutter: Wird dem Tierfutter zugesetzt, um essentielle Nährstoffe bereitzustellen.
- Enteisungsmittel: Wird als Enteisungsmittel zum Schmelzen von Eis und Schnee auf Straßen und Gehwegen verwendet.
- Öl- und Gasbohrungen: Wird als Tonstabilisator bei Öl- und Gasbohrungen verwendet.
- Laborreagenz: Wird als Reagenz in Laborexperimenten und -analysen verwendet.
Fragen:
F: Was ist Kaliumchlorid?
A: Kaliumchlorid (KCl) ist ein weißes kristallines Salz, das aus Kalium- und Chlorionen besteht. Es findet zahlreiche Anwendungen in Branchen wie der Landwirtschaft, der Lebensmittel-, Medizin- und Chemieindustrie.
F: Wofür wird Kaliumchlorid verwendet?
A: Kaliumchlorid wird häufig als Düngemittel, Lebensmittelzusatzstoff und in medizinischen Anwendungen zur Behandlung von Erkrankungen wie Hypokaliämie verwendet. Es kann auch bei der Wasseraufbereitung, in industriellen Prozessen, bei der Tierfütterung, bei der Enteisung, bei Öl- und Gasbohrungen sowie bei Laborexperimenten eingesetzt werden.
F: Ist Kaliumchlorid sicher?
A: Kaliumchlorid kann schädlich sein, wenn es in großen Mengen eingenommen wird oder mit Augen oder Haut in Berührung kommt. Bei der Handhabung oder Verwendung von Kaliumchlorid ist es wichtig, die entsprechenden Sicherheitsrichtlinien und -vorschriften zu befolgen.
F: Ist KCl wasserlöslich?
A: Ja, KCl ist gut wasserlöslich. Bei Raumtemperatur kann sich ein Gramm KCl in 1,5 ml Wasser lösen.
F: Ist KCl ionisch oder kovalent?
A: KCl ist eine ionische Verbindung, da sie aus positiv geladenen Kaliumionen und negativ geladenen Chloridionen besteht, die durch ionische Bindungen zusammengehalten werden.
F: Ist KCl eine Säure oder eine Base?
A: Kaliumchlorid ist eine neutrale Verbindung und weder eine Säure noch eine Base.
F: Ist KCl ein starker Elektrolyt?
A: Ja, KCl ist ein leistungsstarker Elektrolyt, da es beim Auflösen in Wasser vollständig in Kalium- und Chloridionen zerfällt und so eine elektrische Leitfähigkeit ermöglicht.
