Dibasisches Natriumphosphat oder Na2HPO4 ist eine Verbindung, die im Labor häufig als Puffermittel verwendet wird. Es ist auch in manchen Nahrungsmitteln und Getränken als Lebensmittelzusatzstoff enthalten.
| IUPAC-Name | Dinatriumhydrogenphosphat |
| Molekularformel | Na2HPO4 |
| CAS-Nummer | 7558-79-4 |
| Synonyme | Natriumhydrogenphosphat, Dinatriumphosphat, dibasisches Natriumphosphat, wasserfreies dibasisches Natriumphosphat, dibasisches Natriumphosphat-Heptahydrat |
| InChI | InChI=1S/2Na.H3O4P/c;;1-5(2,3)4/h;;(H3,1,2,3,4)/q2*+1;/p-2 |
Molmasse von Na2HPO4
Die Molmasse von dibasischem Natriumphosphat beträgt 141,96 g/mol. Dieser Wert wird berechnet, indem die Atommassen aller in der Verbindung vorhandenen Elemente addiert werden, nämlich Natrium (Na), Phosphor (P) und Sauerstoff (O). Die Molmasse ist ein wichtiger Parameter, der in verschiedenen Berechnungen verwendet wird, beispielsweise um die Menge eines Stoffes zu bestimmen, die zur Durchführung einer Reaktion oder zur Herstellung einer Lösung einer bestimmten Konzentration benötigt wird.
Dinatriumphosphat-Formel
Die chemische Formel für dibasisches Natriumphosphat lautet Na2HPO4. Diese Formel stellt das Verhältnis aller in der Verbindung vorhandenen Elemente dar. Die Formel ist wichtig für die Bestimmung der chemischen Eigenschaften der Verbindung, wie etwa ihrer Reaktivität und Löslichkeit.
Dibasischer Siedepunkt von Natriumphosphat
Dibasisches Natriumphosphat hat keinen definierten Siedepunkt, da es sich vor Erreichen seines Siedepunkts zersetzt. Die Zersetzungstemperatur von dibasischem Natriumphosphat würde jedoch bei etwa 155 °C liegen. Bei Temperaturen über diesem Wert beginnt die Verbindung in ihre Bestandteile Natrium und Phosphat zu zerfallen. Aufgrund dieser Eigenschaft ist es für den Einsatz in Anwendungen, die eine Erwärmung auf hohe Temperaturen erfordern, ungeeignet.
Schmelzpunkt von dibasischem Natriumphosphat
Der Schmelzpunkt von Na2HPO4 variiert je nach der Form, in der es vorliegt. Die wasserfreie Form der Verbindung hat einen Schmelzpunkt von 358 °C, während die Heptahydratform einen niedrigeren Schmelzpunkt von 93 °C hat. Der Schmelzpunkt ist eine wichtige physikalische Eigenschaft zur Identifizierung und Charakterisierung von Stoffen.
Dibasische Dichte von Natriumphosphat g/ml
Die Dichte von Na2HPO4 hängt von der Form ab, in der es vorliegt. Die wasserfreie Form der Verbindung hat eine Dichte von 1,7 g/ml, während die Heptahydratform eine niedrigere Dichte von 1,68 g/ml aufweist. Die Dichte ist eine physikalische Eigenschaft, die die Masse beschreibt, die in einem bestimmten Volumen eines Stoffes enthalten ist.
Zweibasiges Molekulargewicht von Natriumphosphat
Das Molekulargewicht von Na2HPO4 beträgt 141,96 g/mol. Dieser Wert wird durch Addition der Atommassen aller in der Verbindung vorhandenen Elemente berechnet. Das Molekulargewicht ist ein wichtiger Parameter, der in verschiedenen Berechnungen verwendet wird, beispielsweise um die Menge einer Substanz zu bestimmen, die zur Durchführung einer Reaktion oder zur Herstellung einer Lösung einer bestimmten Konzentration benötigt wird.
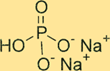
Dibasische Struktur von Natriumphosphat
Na2HPO4 hat eine Kristallstruktur. Die wasserfreie Form der Verbindung ist ein weißes, geruchloses Pulver, während die Heptahydratform ein farbloser, transparenter Kristall ist. Die Verbindung hat eine tetraedrische Form um das Phosphoratom herum, wobei sich jedes Sauerstoffatom an den Ecken des Tetraeders befindet. Natriumionen befinden sich in den Zwischenräumen zwischen den Tetraedern.
| Aussehen | Weißes Pulver oder transparente Kristalle |
| Spezifisches Gewicht | 1,68 – 1,7 g/ml |
| Farbe | Farblos bis weiß |
| Geruch | Geruchlos |
| Molmasse | 141,96 g/Mol |
| Dichte | 1,68 – 1,7 g/ml |
| Fusionspunkt | Wasserfrei: 358 °C, Heptahydrat: 93 °C |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Wasser, unlöslich in Ethanol |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| PKa | 2,15 (Phosphation) |
| PH | 8,0 – 11,0 (0,1 M wässrige Lösung) |
Sicherheit und Gefahren von dibasischem Natriumphosphat
Dibasisches Natriumphosphat (Na2HPO4) gilt im Allgemeinen als sicher für die Verwendung in einer Vielzahl von Anwendungen, kann jedoch Haut- und Augenreizungen verursachen. Das Einatmen der Verbindung in Pulverform kann zu Reizungen der Atemwege führen. Na2HPO4 kann heftig mit starken Säuren und Oxidationsmitteln reagieren und beim Erhitzen auf hohe Temperaturen giftige Dämpfe freisetzen. Wie bei allen Chemikalien sollten beim Umgang mit dieser Verbindung entsprechende Vorsichtsmaßnahmen getroffen werden, z. B. das Tragen von Schutzkleidung und Handschuhen sowie das Arbeiten in einem gut belüfteten Bereich. Bei Haut- oder Augenkontakt mit viel Wasser ausspülen und ggf. einen Arzt aufsuchen.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | S22 – Staub nicht einatmen, S24 – Berührung mit der Haut vermeiden, S37 – Geeignete Handschuhe tragen |
| AN-Kennungen | UN3077 |
| HS-Code | 28352200 |
| Gefahrenklasse | 9 |
| Verpackungsgruppe | III |
| Toxizität | LD50 (Ratte, oral) – 3.400 mg/kg |
Methoden zur Synthese von dibasischem Natriumphosphat
Dibasisches Natriumphosphat (Na2HPO4) kann durch verschiedene Methoden synthetisiert werden, einschließlich der Reaktion von Phosphorsäure mit Natriumhydroxid, der Neutralisation von Phosphorsäure mit Natriumcarbonat oder -bicarbonat und der Reaktion von einbasigem Natriumphosphat mit Natriumhydroxid.
- Eine übliche Methode besteht darin, Phosphorsäure mit Natriumhydroxid im Verhältnis 1:2 zu reagieren, um Na2HPO4 und Wasser zu erzeugen. Die Reaktion kann bei Raumtemperatur oder unter leichtem Erhitzen durchgeführt werden und das resultierende Produkt wird durch Kristallisation oder Eindampfen gereinigt.
- Eine andere Methode besteht darin, die Phosphorsäure mit Natriumcarbonat oder -bicarbonat zu neutralisieren und anschließend Na2HPO4 auszufällen. Der pH-Wert der Reaktionsmischung wird unter Verwendung von Natriumcarbonat oder Bicarbonat auf etwa 8–9 eingestellt, und der resultierende Niederschlag wird gesammelt und mit Wasser gewaschen, um etwaige Verunreinigungen zu entfernen.
- Eine dritte Methode beinhaltet die Reaktion von einbasigem Natriumphosphat mit Natriumhydroxid im Verhältnis 1:1, was zur Bildung von Na2HPO4 und Wasser führt. Das resultierende Produkt wird dann durch Kristallisation oder Eindampfung gereinigt.
Die Wahl der Methode hängt von Faktoren wie gewünschter Reinheit, Ausbeute und Kosteneffizienz ab. Die Synthese von Na2HPO4 kann mit mehreren Methoden durchgeführt werden, von denen jede ihre eigenen Vorteile und Einschränkungen hat.
Verwendung von dibasischem Natriumphosphat
Dibasisches Natriumphosphat hat viele Anwendungen in verschiedenen Branchen.
- Die Lebensmittelindustrie nutzt es als Emulgator, Puffer und Verdickungsmittel. Es wirkt als Komplexbildner und trägt dazu bei, die Qualität und Stabilität der Lebensmittel zu bewahren, indem es verhindert, dass Metallionen mit anderen Lebensmittelbestandteilen reagieren. Es dient als Trennmittel in Backpulver und als pH-Regler in Milchprodukten.
- Die medizinische Industrie verwendet es als Abführmittel zur Behandlung von Verstopfung, indem es den Wassergehalt im Dickdarm erhöht. Es wird auch bei der Herstellung von Medikamenten und Injektionen als pH-Regler und Puffer verwendet.
- In der Landwirtschaft dient es als Dünger und versorgt Pflanzen mit Phosphor.
- Es fungiert auch als Nahrungsergänzungsmittel in Tierfutter.
- Die Wasseraufbereitungsindustrie verwendet Na2HPO4 als Korrosionsinhibitor und Ablagerungsinhibitor in Kesseln und Kühlsystemen.
- Es wirkt als Reinigungsmittel und entfernt Kalzium- und Magnesiumablagerungen von Oberflächen.
Fragen:
F: Ist dibasisches Natriumphosphat ein Konservierungsmittel?
A: Na2HPO4 wird im Allgemeinen nicht als Konservierungsmittel in Lebensmitteln verwendet. Es kann jedoch als Komplexbildner wirken, der dazu beitragen kann, die Qualität und Stabilität von Lebensmitteln zu bewahren, indem es verhindert, dass Metallionen mit anderen Lebensmittelbestandteilen reagieren.
F: Wie viele Mol dibasisches Natriumphosphat (MG 141,98) sind in 50 ml einer 20 % w/v Lösung enthalten?
A: Um die Anzahl der Mol in einer 20 % w/v Lösung von Na2HPO4 zu berechnen, müssen wir zunächst den Gewichts-/Volumenprozentsatz in Gramm/100 ml umrechnen. Eine 20-prozentige w/v-Lösung bedeutet 20 Gramm der Verbindung in 100 ml Lösung. Daher enthalten 50 ml Lösung 10 Gramm Na2HPO4. Um die Anzahl der Mol zu berechnen, dividieren Sie die Masse durch das Molekulargewicht:
Mol = Masse / Molekulargewicht Mol = 10 g / 141,98 g/mol Mol = 0,070 Mol
Daher sind in 50 ml einer 20 %igen Lösung 0,070 Mol Na2HPO4 enthalten.
F: Wie groß ist die Dichte von dibasischem Natriumphosphat?
A: Die Dichte von Na2HPO4 hängt von der Form und Konzentration der Verbindung ab. Die wasserfreie Form hat eine Dichte von etwa 2,36 g/cm³, während die Heptahydratform eine Dichte von etwa 1,62 g/cm³ hat. In Lösung variiert die Dichte je nach Konzentration.
