Neopentan ist ein hochverzweigter Kohlenwasserstoff mit vier Methylgruppen an einem zentralen Kohlenstoffatom. Es wird häufig als Referenzverbindung in der NMR-Spektroskopie und als Kraftstoffadditiv verwendet.
| IUPAC-Name | 2,2-Dimethylpropan |
| Molekularformel | C5H12 |
| CAS-Nummer | 463-82-1 |
| Synonyme | Dimethylpropan, Tetramethylmethan, 2,2-Dimethylpropan, Neo-C5H12, UN 2043 |
| InChI | InChI=1S/C5H12/c1-5(2,3)4/h1-4H3 |
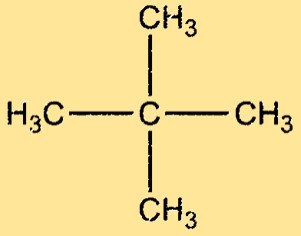
Neopentan-Struktur
Neopentan hat eine stark verzweigte Struktur mit vier Methylgruppen, die an ein zentrales Kohlenstoffatom gebunden sind. Das Molekül ist symmetrisch und tetraedrisch mit einem Bindungswinkel von 109,5° zwischen jedem Paar benachbarter Kohlenstoffatome. Das Neopentanmolekül ist unpolar und weist nur schwache Van-der-Waals-Kräfte zwischen seinen Molekülen auf.
Siedepunkt von Neopentan
Der Siedepunkt von Neopentan liegt bei -9,5 °C (-15 °F) bei Normaldruck. Dieser niedrige Siedepunkt ist auf die schwachen intermolekularen Kräfte zwischen seinen Molekülen zurückzuführen, wodurch es relativ leicht verdampft. Neopentan ist bei Raumtemperatur und -druck ein farbloses Gas und wird häufig als Referenzverbindung für die Gaschromatographie verwendet.
Molmasse von Neopentan
Neopentan, auch bekannt als 2,2-Dimethylpropan, hat eine Molmasse von 72,15 g/mol. Es ist ein hochverzweigter Kohlenwasserstoff mit vier Methylgruppen, die an ein zentrales Kohlenstoffatom gebunden sind. Die Molmasse von Neopentan kann durch Addition der Atomgewichte aller Atome in seiner Summenformel C5H12 berechnet werden.
Schmelzpunkt von Neopentan
Der Schmelzpunkt von Neopentan beträgt -16,6 °C (2 °F) bei Standarddruck. Der niedrige Schmelzpunkt von Neopentan resultiert ebenso wie sein Siedepunkt aus seinen schwachen intermolekularen Kräften. Neopentan ist ein unpolares Molekül mit nur schwachen Van-der-Waals-Kräften zwischen seinen Molekülen und bildet daher keine starken Kristallstrukturen.
Neopentandichte g/ml
Die Dichte von Neopentan beträgt 0,623 g/ml bei Standardtemperatur und -druck. Diese geringe Dichte ist auf das niedrige Molekulargewicht von Neopentan zurückzuführen, das nur 72,15 g/mol beträgt. Neopentan hat eine geringere Dichte als Wasser und schwimmt daher auf der Wasseroberfläche, wenn die beiden vermischt werden.
Molekulargewicht von Neopentan
Das Molekulargewicht von Tetramethylmethan beträgt 72,15 g/mol. Dieser Wert stellt die Summe der Atomgewichte aller Atome des Moleküls dar, das aus fünf Kohlenstoffatomen und 12 Wasserstoffatomen besteht. Das niedrige Molekulargewicht von Tetramethylmethan macht es zu einer leicht flüchtigen und entzündlichen Verbindung.
Tetramethylmethan-Formel
Die Summenformel für Tetramethylmethan lautet C5H12 und gibt die Anzahl und Art der im Molekül vorhandenen Atome an. Die Formel besagt, dass das Tetramethylmethan-Molekül fünf Kohlenstoffatome und zwölf Wasserstoffatome enthält. Die Summenformel gibt keine Auskunft über die Anordnung der Atome innerhalb des Moleküls, die durch dessen Struktur bestimmt wird.
| Aussehen | Farbloses Gas |
| Spezifisches Gewicht | 0,623 g/ml bei 20 °C |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 72,15 g/Mol |
| Dichte | 0,623 g/ml bei 20 °C |
| Fusionspunkt | -16,6°C |
| Siedepunkt | -9,5°C |
| Blitzpunkt | -49°C |
| Löslichkeit in Wasser | 0,04 g/L bei 20°C |
| Löslichkeit | Nicht in Wasser löslich |
| Dampfdruck | 566 mmHg bei 20°C |
| Wasserdampfdichte | 2,5 (Luft = 1) |
| pKa | ~50 |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Neopentan
Tetramethylmethan ist ein leicht entzündliches Gas und kann mit Luft explosive Gemische bilden. Außerdem kann es bei Hautkontakt zu Erfrierungen führen, da der Siedepunkt mit -9,5 °C sehr niedrig ist. Das Einatmen von Tetramethylmethangas kann Schwindel, Übelkeit und Kopfschmerzen verursachen. Es ist wichtig, vorsichtig mit Tetramethylmethan umzugehen und den Kontakt mit Flammen, Funken oder anderen Zündquellen zu vermeiden. Tetramethylmethan sollte an einem kühlen, trockenen und gut belüfteten Ort gelagert werden, geschützt vor Hitze und Oxidationsmitteln. Beim Umgang mit Tetramethylmethan sollte geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden.
| Gefahrensymbole | F+ |
| Sicherheitsbeschreibung | Leicht entzündliches Gas. Kann Erfrierungen verursachen. Nur in einem gut belüfteten Bereich verwenden. Von Hitze und Zündquellen fernhalten. Schutzhandschuhe und Schutzbrille tragen. |
| EINE ID | UN2451 |
| HS-Code | 2901.1 |
| Gefahrenklasse | 2.1 |
| Verpackungsgruppe | Keiner |
| Toxizität | Geringe Toxizität |
Neopentan-Synthesemethoden
Es gibt verschiedene Methoden zur Synthese von Tetramethylmethan.
Eine übliche Methode beinhaltet die Reaktion von Isobuten und Formaldehyd an einem festen Säurekatalysator wie Zeolith. Bei der Reaktion entsteht Neopentylalkohol, der dann zu Tetramethylmethan dehydriert werden kann.
Eine weitere Methode zur Synthese von Tetramethylmethan beinhaltet die thermische Zersetzung von 2,2-Dimethylpropan bei hohen Temperaturen. Bei dieser Reaktion entstehen Tetramethylmethan und andere Kohlenwasserstoffe.
Eine dritte Methode beinhaltet die Reaktion von Ethylchlorid und Zink in Gegenwart von Magnesium zur Herstellung von Diethylzink, das dann mit Isobutylen zu Tetramethylmethan reagieren kann.
Tetramethylmethan kann durch Hydrierung von Isopenten synthetisiert werden, das bei der Dehydrierung von Isopentan entsteht.
Abhängig von verschiedenen Faktoren wie Verfügbarkeit der Rohstoffe, Kosten, gewünschter Ausbeute und Reinheit des Endprodukts können unterschiedliche Methoden der Tetramethylmethan-Synthese angepasst werden.
Verwendung von Neopentan
Tetramethylmethan hat mehrere wichtige industrielle und wissenschaftliche Anwendungen.
- Aufgrund seiner hohen Reinheit und genau definierten Eigenschaften wird es als Referenzmaterial für die Gaschromatographie verwendet.
- Tetramethylmethan wird auch als Standard für kalorimetrische und thermodynamische Messungen verwendet.
- Eine weitere wichtige Verwendung von Tetramethylmethan ist die Verwendung als Treibmittel bei der Herstellung von Polyurethanschäumen, die in einer Vielzahl von Anwendungen wie Isolierung, Polsterung und Verpackung eingesetzt werden.
- Aufgrund seines niedrigen Siedepunkts und seiner guten thermodynamischen Eigenschaften wird es als Kältemittel in Kühlsystemen eingesetzt. Aufgrund seiner hohen Entflammbarkeit und möglichen Umweltauswirkungen wurde jedoch weitgehend auf seine Verwendung als Kältemittel verzichtet.
- Tetramethylmethan wird auch bei der Synthese anderer organischer Verbindungen verwendet, beispielsweise Neopentylglykol, das bei der Herstellung von Harzen, Beschichtungen und Kunststoffen verwendet wird.
Seine einzigartigen Eigenschaften machen es zu einer vielseitigen und wertvollen Verbindung für verschiedene industrielle und wissenschaftliche Anwendungen. Allerdings müssen die potenziellen Gefahren von Tetramethylmethan sorgfältig abgewogen und gemanagt werden, um eine sichere und verantwortungsvolle Verwendung zu gewährleisten.
Fragen:
F: Wie viele chirale Kohlenstoffatome hat Neopentan (2,2-Dimethylpropan)?
A: Neopentan hat keine chiralen Kohlenstoffatome. Es ist ein symmetrisches Molekül mit tetraedrischer Geometrie um jedes Kohlenstoffatom, sodass alle Kohlenstoffatome gleichwertig sind.
F: Was hat den höheren Siedepunkt: Hexan, Pentan oder Neopentan?
A: Hexan hat den höchsten Siedepunkt, gefolgt von Pentan und Neopentan. Tatsächlich steigt der Siedepunkt eines Kohlenwasserstoffs mit seinem Molekulargewicht und seiner spezifischen Oberfläche sowie mit der Stärke seiner intermolekularen Kräfte. Hexan hat unter den drei Verbindungen das höchste Molekulargewicht und die höchste spezifische Oberfläche und weist aufgrund seiner linearen Struktur auch die stärksten intermolekularen Kräfte auf, was zu einem höheren Siedepunkt führt. Pentan und Neopentan haben aufgrund ihrer kleineren Molekülgröße und schwächeren intermolekularen Kräfte niedrigere Siedepunkte.
