Chlor (Cl2) ist ein sehr reaktives grünlich-gelbes Gas. Es wird bei der Wasseraufbereitung, als Desinfektionsmittel und bei der Herstellung verschiedener Chemikalien wie PVC und Lösungsmittel eingesetzt.
| IUPAC-Name | Dichlor |
| Molekularformel | Cl2 |
| CAS-Nummer | 7782-50-5 |
| Synonyme | Molekulares Chlor, Chlor, Cloro, Chlor, Chloor, Cloreto de cloro |
| InChI | InChI=1S/Cl2/c1-2 |
Cl2 Molmasse
Die Molmasse von Cl2 oder Chlor ist die Summe der Atommassen zweier Chloratome oder 70,906 g/mol. Bei der Berechnung der Stoffmenge, die für eine chemische Reaktion benötigt wird, oder bei der Umrechnung zwischen verschiedenen Maßeinheiten ist es wichtig, die Molmasse von Cl2 zu kennen.
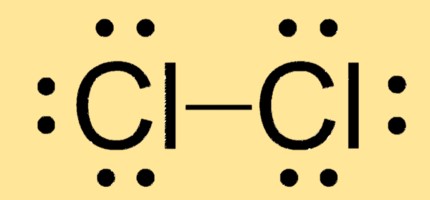
Lewis-Struktur Cl2
Cl2 hat eine lineare Molekülgeometrie mit zwei Chloratomen, die durch eine einzige kovalente Bindung verbunden sind. Seine Lewis-Struktur besteht aus zwei Cl-Atomen mit jeweils drei freien Elektronenpaaren und einem gemeinsamen Elektronenpaar.
Siedepunkt Cl2
Der Siedepunkt von Cl2 beträgt -34,04 °C (-29,27 °F) bei Normaldruck. Dies ist ein relativ niedriger Siedepunkt, der bei Raumtemperatur und -druck gasförmiges Cl2 erzeugt. Beim Umgang mit Cl2 ist Vorsicht geboten, da es bei niedrigen Temperaturen und niedrigem Druck leicht flüssig oder fest werden kann.
Cl2 Schmelzpunkt
Der Schmelzpunkt von Cl2 beträgt -101,5 °C (-150,7 °F) bei Standarddruck. Dies ist ein relativ niedriger Schmelzpunkt, der bei Raumtemperatur und -druck gasförmiges Cl2 erzeugt. Beim Umgang mit Cl2 ist Vorsicht geboten, da es bei niedrigen Temperaturen und niedrigem Druck leicht flüssig oder fest werden kann.
Cl2-Dichte g/ml
Die Dichte von Cl2 beträgt 0,003214 g/ml bei Standardtemperatur und -druck (STP). Das bedeutet, dass Cl2 eine viel geringere Dichte als Luft hat und in die Atmosphäre aufsteigt. Cl2 kann in Druckflaschen oder in Tanks gelagert werden, die Gase enthalten, die schwerer als Luft sind, beispielsweise Stickstoff.
Molekulargewicht von Chlor
Das Molekulargewicht von Cl2 beträgt 70,906 g/mol. Dies ist die Masse eines Mols Cl2, das Avogadros Anzahl an Molekülen enthält (6,022 x 10^23). Das Molekulargewicht von Cl2 ist wichtig für stöchiometrische Berechnungen in der Chemie.
Struktur von Chlor
Die Struktur von Cl2 ist linear, wobei zwei Chloratome durch eine kovalente Bindung miteinander verbunden sind. Die Bindungslänge zwischen den beiden Chloratomen beträgt 1,99 Ångström und die Bindungsenergie beträgt 242 kJ/mol. Die elektronische Konfiguration von Cl2 ist [Ne]3s23p5, wobei jedes Chloratom ein Elektron zum Bindungspaar beiträgt.
Chlorformel
Die Formel für Cl2 besteht einfach aus zwei miteinander verbundenen Cl-Atomen. Dies wird durch Cl-Cl oder Cl2 dargestellt. Die Formel ist wichtig, um die Zusammensetzung einer Verbindung oder eines Moleküls zu ermitteln und für stöchiometrische Berechnungen in der Chemie.
| Aussehen | Grünlich-gelbes Gas |
| Spezifisches Gewicht | 1,56 (flüssig) |
| Farbe | grünlich-gelb |
| Geruch | Stechender und erstickender Geruch |
| Molmasse | 70,906 g/Mol |
| Dichte | 0,003214 g/ml bei STP |
| Fusionspunkt | -101,5 °C (-150,7 °F) |
| Siedepunkt | -34,04°C (-29,27°F) |
| Blitzpunkt | Nicht brennbar |
| Löslichkeit in Wasser | 0,92 g/100 ml bei 20 °C |
| Löslichkeit | Löslich in Wasser, Ethanol, Ether, Benzol und vielen organischen Lösungsmitteln |
| Dampfdruck | 102,44 kPa bei 20 °C |
| Wasserdampfdichte | 2,49 (Luft = 1) |
| pKa | – |
| pH-Wert | – |
Cl2 Sicherheit und Gefahren
Chlor ist ein hochreaktives Gas, das bei unsachgemäßer Handhabung ein ernstes Sicherheits- und Gesundheitsrisiko darstellen kann. Es kann schwere Reizungen der Atemwege sowie Schäden an Augen, Haut und Schleimhäuten verursachen. Das Einatmen hoher Chlorkonzentrationen kann zu Lungenödemen führen, die lebensbedrohlich sein können. Chlor ist außerdem sehr ätzend und kann Metalle, Kunststoffe und andere Materialien beschädigen. Um einen sicheren Umgang mit Chlor zu gewährleisten, sollte geeignete persönliche Schutzausrüstung wie Schutzbrille, Handschuhe und Atemschutzmaske getragen werden. Chlor sollte nur in gut belüfteten Bereichen verwendet werden und alle Behälter sollten ordnungsgemäß gekennzeichnet und an einem sicheren Ort aufbewahrt werden.
| Gefahrensymbole | Totenkopf |
| Sicherheitsbeschreibung | Hochgiftiges und ätzendes Gas; verursacht schwere Reizungen der Atemwege und der Haut; kann bei Einatmen in hohen Konzentrationen tödlich sein |
| UN-Identifikationsnummern | UN1017 |
| HS-Code | 2801.1 |
| Gefahrenklasse | 2.3 |
| Verpackungsgruppe | ICH |
| Toxizität | Sehr giftig; Das Einatmen hoher Konzentrationen kann Lungenödeme verursachen und tödlich sein |
Methoden der Chlorsynthese
Es gibt verschiedene Methoden zur Synthese von Chlorgas, darunter Soleelektrolyse, HCl-Oxidation und thermische Zersetzung von Metallchloriden.
Die gebräuchlichste Methode ist die Soleelektrolyse, bei der elektrischer Strom durch eine Lösung aus Natriumchlorid (NaCl) und Wasser (H2O) geleitet wird. Bei diesem Prozess entsteht an der Anode Chlorgas und an der Kathode Wasserstoffgas.
Eine weitere Methode zur Herstellung von Chlor ist die Oxidation von HCl mit einem Oxidationsmittel wie KMnO4 oder MnO2. Bei dieser Reaktion entstehen Chlorgas und Wasser als Nebenprodukte.
Die thermische Zersetzung von Metallchloriden wie MgCl2 oder FeCl3 ist eine weitere Methode zur Erzeugung von Chlorgas. Bei diesem Prozess wird das Metallchlorid auf eine hohe Temperatur erhitzt, wodurch es sich zersetzt und Chlorgas freisetzt.
Insgesamt hängt die Synthesemethode für Chlor von der konkreten Anwendung und der gewünschten Reinheit des Gases ab. Unabhängig von der verwendeten Methode ist es wichtig, mit Chlor aufgrund seiner hochreaktiven und toxischen Natur vorsichtig umzugehen.
Verwendung von Chlor
Chlorgas hat vielfältige Einsatzmöglichkeiten in verschiedenen Branchen. Eine der Hauptanwendungen von Chlor ist die Herstellung von Polyvinylchlorid (PVC), einem weit verbreiteten Kunststoffmaterial. Chlor wird auch bei der Herstellung anderer Chlorverbindungen wie Chloroform und Tetrachlorkohlenstoff verwendet, die als Lösungsmittel und bei der Herstellung von Kältemitteln verwendet werden.
In der Wasseraufbereitungsindustrie wird Chlor häufig als Desinfektionsmittel zur Aufbereitung von Trink- und Abwasser eingesetzt. Chlorgas ist wirksam bei der Abtötung von Bakterien und Viren und kann außerdem organische Verbindungen und andere Verunreinigungen oxidieren und aus dem Wasser entfernen.
In der Zellstoff- und Papierindustrie wird Chlorgas als Bleichmittel zum Aufhellen von Papierprodukten verwendet. Es wird auch bei der Herstellung von Textilien wie Nylon und Polyester sowie bei der Herstellung von Farbstoffen und Pigmenten verwendet.
Chlorgas findet auch andere Anwendungen, insbesondere bei der Herstellung bestimmter pharmazeutischer Produkte und in der metallurgischen Industrie zum Abbeizen und Reinigen von Metalloberflächen. Aufgrund seiner Gefährlichkeit muss Chlor jedoch mit Vorsicht gehandhabt werden und bei Lagerung, Transport und Verwendung müssen entsprechende Sicherheitsvorkehrungen getroffen werden.
Fragen:
F: Ist Cl2 polar oder unpolar?
A: Cl2 ist ein unpolares Molekül.
F: Ist Chlor ein Metall?
A: Nein, Chlor ist kein Metall. Es ist ein Halogen und gehört zur Gruppe der nichtmetallischen Elemente.
F: Welches Weichmetall verbindet sich mit Chlor zu Speisesalz?
A: Natrium (Na) ist das weiche Metall, das sich mit Chlor (Cl) zu Speisesalz (NaCl) verbindet.
F: Wie chlort man Wasser?
A: Die Chlorierung von Wasser erfolgt im Allgemeinen durch Zugabe einer abgemessenen Menge Chlorgas, Natriumhypochlorit oder Calciumhypochlorit zur Wasserversorgung. Die Menge des zugesetzten Chlors hängt von der Wasserqualität und dem gewünschten Desinfektionsgrad ab. Chlor reagiert mit Bakterien und anderen Mikroorganismen im Wasser, tötet diese wirksam ab und macht das Wasser trinkbar.
F: Welche der folgenden Substanzen wird mit Chlor behandelt, um Bleichpulver zu erhalten?
A: Calciumoxid (CaO) wird mit Chlor (Cl2) behandelt, um Bleichpulver (CaOCl2) zu erhalten.
