Chlorheptoxid oder Cl2O7 ist eine hochexplosive und reaktive Verbindung. Es kann sich bei Kontakt mit organischem Material heftig zersetzen und ist ein starkes Oxidationsmittel, das in der chemischen Synthese und Analyse verwendet wird.
| IUPAC-Name | Chlorheptoxid |
| Molekularformel | Cl2O7 |
| CAS-Nummer | 12015-53-1 |
| Synonyme | Perchlorsäureanhydrid, Dichlorheptoxid, Chlor(VII)-oxid, Chloroxid, Perchlorylperchlorat |
| InChI | InChI=1S/Cl2O7/c2-1(3,4,5,6)10-7(8,9)11-12-13-14-10 |
Molmasse von Chlorheptoxid
Chlorheptoxid, chemische Formel Cl2O7, hat eine Molmasse von 182,9 g/mol. Diese Verbindung besteht aus zwei Chloratomen und sieben Sauerstoffatomen und ist daher ein stark oxidierendes Mittel. Die Molmasse von Chlorheptoxid wird verwendet, um mithilfe der Avogadro-Konstante die Stoffmenge in einer bestimmten Masse oder einem bestimmten Volumen einer Probe zu berechnen.
Siedepunkt von Chlorheptoxid
Chlorheptoxid ist ein farbloser bis gelblicher, hochreaktiver und flüchtiger Feststoff. Der Siedepunkt von Chlorheptoxid ist nicht genau definiert, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Chlorheptoxid ist ein starkes Oxidationsmittel, das mit organischem Material, Wasser und anderen Substanzen reagieren und explosive Verbindungen bilden kann.
Schmelzpunkt von Chlorheptoxid
Chlorheptoxid hat einen Schmelzpunkt von -96 °C (-141 °F) und ist damit ein Feststoff mit niedrigem Schmelzpunkt. Aufgrund seines niedrigen Schmelzpunkts und seiner hohen Reaktivität kann Chlorheptoxid bei Raumtemperatur als gelbliche Flüssigkeit vorliegen. Es ist wichtig, vorsichtig mit Chlorheptoxid umzugehen, da es schwere Verbrennungen verursachen kann und ein starkes Oxidationsmittel ist.
Dichte von Chlorheptoxid g/ml
Die Dichte von Chlorheptoxid beträgt bei Raumtemperatur 2,48 g/ml. Die hohe Dichte von Chlorheptoxid macht es zu einer dichten Flüssigkeit, die schnell auf den Boden eines Behälters sinken kann. Die hohe Dichte und Reaktivität von Chlorheptoxid erschweren die Handhabung und erfordern besondere Sicherheitsvorkehrungen bei der Verwendung in der chemischen Synthese oder Analyse.
Molekulargewicht von Chlorheptoxid
Das Molekulargewicht von Chlorheptoxid, auch relative Molekularmasse genannt, beträgt 182,9 g/mol. Das Molekulargewicht von Chlorheptoxid ist wichtig für chemische Berechnungen, bei denen es um Stoffmenge, Masse und Volumen geht. Das hohe Molekulargewicht von Chlorheptoxid macht es zu einer dichten, flüchtigen Verbindung, die sorgfältige Handhabung und Lagerung erfordert.
Struktur von Chlorheptoxid
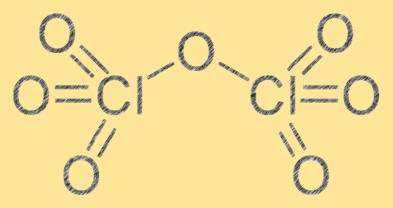
Die Struktur von Chlorheptoxid besteht aus zwei Chloratomen und sieben Sauerstoffatomen. Es hat die Summenformel Cl2O7 und seine Molekülgeometrie ist aufgrund der Abstoßung zwischen Sauerstoffatomen eine verzerrte Oktaederform. Chlorheptoxid ist ein starkes Oxidationsmittel und kann mit verschiedenen organischen und anorganischen Substanzen reagieren. Die Struktur von Chlorheptoxid ist wichtig für das Verständnis seiner chemischen Eigenschaften und seines Verhaltens bei verschiedenen Reaktionen.
Chlorheptoxid-Formel
Die chemische Formel für Chlorheptoxid lautet Cl2O7. Die Formel besagt, dass jedes Molekül Chlorheptoxid zwei Chloratome und sieben Sauerstoffatome enthält. Die Formel wird zur Berechnung der Stöchiometrie chemischer Reaktionen unter Beteiligung von Chlorheptoxid verwendet. Die Formel von Chlorheptoxid ist auch wichtig für die Bestimmung seines Molekulargewichts, seiner Dichte und anderer physikalischer und chemischer Eigenschaften.
| Aussehen | Farbloser bis gelblicher Feststoff |
| Spezifisches Gewicht | 2,48 bei 25°C |
| Farbe | Farblos bis gelblich |
| Geruch | Würzig, sauer |
| Molmasse | 182,9 g/Mol |
| Dichte | 2,48 g/ml bei 25 °C |
| Fusionspunkt | -96°C (-141°F) |
| Siedepunkt | Zersetzt sich vor dem Siedepunkt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert heftig mit Wasser |
| Löslichkeit | Löslich in organischen Lösungsmitteln |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Chlorheptoxid
Chlorheptoxid ist eine hochreaktive und gefährliche Verbindung, die bei unsachgemäßer Handhabung erhebliche Sicherheitsrisiken birgt. Bei Kontakt kann es zu schweren Verbrennungen und Schäden an Augen, Haut und Atemwegen kommen. Chlorheptoxid kann auch heftig mit Wasser und organischen Materialien reagieren und Explosionen und Brandgefahr verursachen. Beim Umgang mit Chlorheptoxid ist die Verwendung geeigneter persönlicher Schutzausrüstung, einschließlich Handschuhen, Schutzbrillen und Atemschutzmasken, unerlässlich. Die Masse sollte in einem sicheren, dicht verschlossenen Behälter gelagert und transportiert werden, fern von Zünd-, Hitze- oder Feuchtigkeitsquellen. Um die mit Chlorheptoxid verbundenen Risiken zu minimieren, sollten ordnungsgemäße Handhabungsverfahren und Sicherheitsvorkehrungen befolgt werden.
| Gefahrensymbole | Oxidationsmittel, ätzend |
| Sicherheitsbeschreibung | Kontakt mit Wasser, Säuren, organischen Stoffen und Reduktionsmitteln vermeiden. Verwenden Sie geeignete persönliche Schutzausrüstung. In einem dicht verschlossenen Behälter fern von Hitze, Feuchtigkeit und Zündquellen aufbewahren. Bei Kontakt mit Augen, Haut oder Atemwegen sofort einen Arzt aufsuchen. |
| UN-Identifikationsnummern | UN 3083 |
| HS-Code | 28299090 |
| Gefahrenklasse | 5.1 (Oxidierende Materialien) |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig beim Einatmen, Verschlucken oder Hautabsorption. Verursacht schwere Verbrennungen und Gewebeschäden. Kann bei Kontakt mit Wasser, organischen Materialien und anderen reaktiven Substanzen zu Explosionen und Brandgefahr führen. |
Methoden zur Synthese von Chlorheptoxid
Chlorheptoxid ist eine hochreaktive Verbindung und schwer zu synthetisieren.
Eine der gebräuchlichsten Methoden zur Synthese von Chlorheptoxid ist die Reaktion von Chlorgas und Ozon. Diese Reaktion ist exotherm und kann zu einer explosiven Reaktion führen, wenn sie nicht sorgfältig kontrolliert wird.
Eine andere Methode beinhaltet die Reaktion von Chlorgas mit Kaliumchlorat, wobei als Nebenprodukte Chlorheptoxid und Kaliumchlorid entstehen. Diese Methode erfordert außerdem eine sorgfältige Kontrolle der Reaktionsbedingungen, um die Bildung explosiver Zwischenprodukte zu verhindern.
Chlorheptoxid kann durch Reaktion von Chlorgas mit Dichlorpentoxid synthetisiert werden, wobei als Nebenprodukte Chlorheptoxid und Dichlorhexoxid entstehen. Aufgrund der Gefährlichkeit von Dichlorpentoxid wird diese Methode von Forschern jedoch nicht häufig angewendet.
Andere Methoden zur Synthese von Chlorheptoxid umfassen die Reaktion von Chlorgas mit verschiedenen organischen Verbindungen wie Benzol oder Toluol unter kontrollierten Bedingungen. Diese Methoden erfordern jedoch eine sorgfältige Optimierung der Reaktionsbedingungen und sind nicht so zuverlässig oder werden nicht so häufig verwendet wie die Chlor-Ozon- oder Chlor-Kaliumchlorat-Methoden.
Insgesamt erfordert die Synthese von Chlorheptoxid eine sorgfältige Kontrolle der Reaktionsbedingungen und birgt aufgrund der hochreaktiven Natur der Verbindung erhebliche Sicherheitsrisiken. Bei der Arbeit mit Chlorheptoxid oder anderen gefährlichen Stoffen sollten Sicherheitsvorkehrungen und ordnungsgemäße Handhabungsverfahren befolgt werden.
Verwendung von Chlorheptoxid
- Cl2O7 findet seine Hauptanwendung als Oxidationsmittel in der chemischen Synthese und Forschung.
- Es wirkt als starkes Oxidationsmittel und reagiert mit einer Vielzahl organischer und anorganischer Verbindungen, wodurch es bei vielen chemischen Reaktionen nützlich ist.
- Eine der häufigsten Anwendungen von Cl2O7 ist die Herstellung von Chlordioxid, einem starken Desinfektions- und Bleichmittel, das in der Wasseraufbereitung, der Zellstoff- und Papierproduktion sowie der Textilherstellung eingesetzt wird.
- Es wird auch als starkes Oxidationsmittel bei der Synthese mehrerer organischer Verbindungen verwendet, darunter Pharmazeutika und Agrochemikalien.
- Cl2O7 wird in Wissenschaft und Forschung verwendet, um die Reaktivität verschiedener organischer und anorganischer Verbindungen zu untersuchen. Es dient auch als Katalysator bei der Synthese bestimmter Verbindungen wie Epoxidharze und Essigsäureanhydrid.
- Aufgrund seiner Gefährlichkeit wird Cl2O7 in großtechnischen Industrieanwendungen im Allgemeinen nicht verwendet. Es erfordert eine sorgfältige Handhabung und Lagerung, um die Bildung explosiver Zwischenprodukte und andere Sicherheitsrisiken zu vermeiden.
Insgesamt ist Cl2O7 eine nützliche Verbindung in der chemischen Synthese und Forschung, erfordert jedoch Sicherheitsvorkehrungen und ordnungsgemäße Handhabungsverfahren, um die mit seiner Verwendung verbundenen Risiken zu minimieren.
Fragen:
F: Was ist Cl2O7?
A: Cl2O7 ist eine chemische Verbindung bestehend aus zwei Chloratomen und sieben Sauerstoffatomen mit der chemischen Formel Cl2O7.
F: Wie lautet der korrekte Name für Cl2O7?
A: Der korrekte Name für Cl2O7 ist Dichlorheptoxid.
F: Ist Cl2O7 ionisch oder kovalent?
A: Cl2O7 ist eine kovalente Verbindung. Es besteht aus zwei nichtmetallischen Elementen, Chlor und Sauerstoff, und bildet durch die gemeinsame Nutzung von Elektronen zwischen Atomen eine molekulare Verbindung.
F: Welches der folgenden Oxide reagiert mit Wasser unter Bildung einer schwachen Säure? MgO, Cl2O7, P4O10, Bi2O3, N2O5.
A: Das Oxid, das mit Wasser unter Bildung einer schwachen Säure reagiert, ist N2O5. Wenn N2O5 mit Wasser reagiert, entsteht Salpetersäure, eine schwache Säure. Die anderen aufgeführten Oxide MgO, P4O10, Bi2O3 und Cl2O7 reagieren nicht mit Wasser unter Bildung schwacher Säuren.
