Stickstofftrifluorid oder NF3 ist ein starkes Treibhausgas, das in der Elektronikindustrie zum Plasmaätzen und Reinigen verwendet wird. Es hat eine lange Lebensdauer in der Atmosphäre und trägt zum Klimawandel bei.
| IUPAC-Name | Stickstofftrifluorid |
| Molekularformel | NF3 |
| CAS-Nummer | 7783-54-2 |
| Synonyme | Trifluoramin, Stickstofffluorid (NF3), Stickstofffluorid (1:3), Stickstofffluorid (NF3), Stickstoff(III)fluorid, Stickstofffluorid, Tablette, UN 2451 |
| InChI | InChI=1S/F3N/c1-4(2)3 |
Molmasse von Stickstofftrifluorid
Die Molmasse von NF3 beträgt 71,0 g/mol. Das bedeutet, dass ein Mol NF3 6.022 x 10^23 Moleküle enthält.
Siedepunkt von Stickstofftrifluorid
NF3 hat einen Siedepunkt von -129,04 °C oder -200,27 °F. Dieser ist im Vergleich zu anderen Gasen relativ gering, was die Handhabung in industriellen Anwendungen erleichtert.
Stickstofftrifluorid Schmelzpunkt
Stickstofftrifluorid hat einen Schmelzpunkt von -206,73 °C oder -340,11 °F. Das bedeutet, dass sich NF3 bei Raumtemperatur im gasförmigen Zustand befindet.
NF3-Dichte g/ml
Die Dichte von NF3 beträgt 1,88 g/ml bei Standardtemperatur und -druck. Das bedeutet, dass Stickstofftrifluorid dichter als Luft ist und bei Freisetzung in die Atmosphäre zu Boden sinkt.
Molekulargewicht von Stickstofftrifluorid
Das Molekulargewicht von NF3 beträgt 71,0 g/mol. Es ist die Summe der Atomgewichte von Stickstoff und Fluor in der Verbindung.
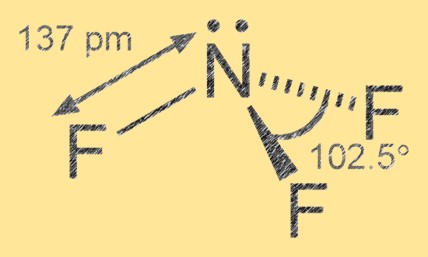
Struktur von Stickstofftrifluorid
Stickstofftrifluorid hat eine trigonal-pyramidale Molekülgeometrie mit Stickstoff als Zentralatom und drei ihn umgebenden Fluoratomen. Die Stickstoff-Fluor-Bindung ist polar kovalent, wobei die Fluoratome elektronegativer sind als der Stickstoff, was zu einer teilweise negativen Ladung der Fluoratome und einer teilweise positiven Ladung des Stickstoffatoms führt.
Stickstofftrifluorid-Formel
Die chemische Formel von Stickstofftrifluorid lautet NF3, was bedeutet, dass ein Molekül NF3 ein Stickstoffatom und drei Fluoratome enthält.
| Aussehen | Farbloses Gas |
| Spezifisches Gewicht | 2,62 |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 71,0 g/Mol |
| Dichte | 1,88 g/ml bei STP |
| Fusionspunkt | -206,73 °C oder -340,11 °F |
| Siedepunkt | -129,04 °C oder -200,27 °F |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | 0,41 g/100 ml bei 25 °C |
| Löslichkeit | Löslich in organischen Lösungsmitteln |
| Dampfdruck | 315 kPa bei 20°C |
| Wasserdampfdichte | 2,01 (Luft = 1) |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Stickstofftrifluorid
Stickstofftrifluorid (NF3) gilt bei korrekter Handhabung im Allgemeinen als sicher, kann jedoch bei falscher Handhabung mehrere Gefahren bergen. Es kann zu Haut- und Augenreizungen führen und das Einatmen hoher Konzentrationen kann zu Atembeschwerden führen. NF3-Gas kann in schlecht belüfteten Bereichen Sauerstoff verdrängen und zur Erstickung führen. Es ist auch ein starkes Treibhausgas, das zum Klimawandel beiträgt. Im Brandfall kann NF3 giftiges Fluorwasserstoffgas freisetzen. Um diese Gefahren zu vermeiden, ist es wichtig, beim Umgang mit NF3 ordnungsgemäße Sicherheitsprotokolle zu befolgen, einschließlich ausreichender Belüftung und Verwendung von Schutzausrüstung.
| Gefahrensymbole | T, C |
| Sicherheitsbeschreibung | Einatmen und Kontakt mit Haut und Augen vermeiden. Nur in gut belüfteten Bereichen verwenden. |
| UN-Identifikationsnummern | UN2451 |
| HS-Code | 28129090 |
| Gefahrenklasse | 2.3 |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig |
Methoden zur Synthese von Stickstofftrifluorid
Es gibt mehrere Methoden zur Synthese von Stickstofftrifluorid (NF3):
Eine übliche Methode beinhaltet die Reaktion von wasserfreiem Ammoniak (NH3) mit Fluorgas (F2) in Gegenwart eines Katalysators wie Eisen, Nickel oder Platin. Bei der Reaktion entstehen NF3 und Fluorwasserstoff (HF). In der Industrie wird diese Methode üblicherweise zur Herstellung von NF3 verwendet.
Eine andere Methode beinhaltet die thermische Zersetzung von Ammoniumfluorid (NH4F) bei hohen Temperaturen. Bei der Reaktion entstehen NF3 und Ammoniakgas (NH3). Die Reaktion von NH3 mit F2 ist effizienter als diese Methode und wird daher weniger häufig verwendet.
Eine andere Methode beinhaltet die Reaktion von Stickoxid (NO) mit Fluorgas in Gegenwart eines Katalysators. Bei der Reaktion entstehen die Gase NF3 und Stickstoffdioxid (NO2).
NF3 kann auch elektrochemisch synthetisiert werden, indem eine elektrische Entladung durch eine Mischung aus N2- und F2-Gasen geleitet wird. Das entstehende Plasma bildet NF3 und andere Stickstoff-Fluor-Verbindungen.
Unabhängig von der verwendeten Methode ist es von entscheidender Bedeutung, hochreaktive und potenziell gefährliche Reagenzien mit entsprechenden Sicherheitsvorkehrungen zu handhaben. Allerdings müssen Forscher den Syntheseprozess sorgfältig kontrollieren, um eine hohe Ausbeute und Reinheit des Endprodukts sicherzustellen.
Verwendung von Stickstofftrifluorid
Stickstofftrifluorid (NF3) findet aufgrund seiner einzigartigen Eigenschaften verschiedene industrielle Anwendungen.
- Die Halbleiterindustrie verwendet NF3 als Reinigungsmittel für Siliziumwafer. NF3 wird auch bei der Herstellung von Flachbildschirmen, Solarzellen und mikroelektromechanischen Systemen (MEMS) verwendet.
- Bei der Herstellung elektronischer Komponenten wird NF3 als Plasmaätzgas verwendet. Es weist eine hohe Reaktivität auf und entfernt selektiv bestimmte Materialien, während andere intakt bleiben.
- Kühlsysteme verwenden NF3 auch als Kältemittel, da es im Vergleich zu anderen Kältemitteln ein geringeres Treibhauspotenzial aufweist, was es zu einer umweltfreundlicheren Option macht.
- Die Luft- und Raumfahrtindustrie nutzt NF3 aufgrund seines hohen spezifischen Impulses als Treibstoff, der einen effizienten Antrieb von Raumfahrzeugen ermöglicht.
Trotz seiner vielfältigen Verwendungsmöglichkeiten bestehen Bedenken hinsichtlich der Umweltauswirkungen von NF3. Es ist ein starkes Treibhausgas mit einer langen Lebensdauer in der Atmosphäre. Die Produktion und Verwendung von NF3 kann zum Klimawandel beitragen, wenn keine geeigneten Vorsichtsmaßnahmen getroffen werden. Aus diesem Grund werden Anstrengungen unternommen, den Verbrauch zu reduzieren und nachhaltigere Alternativen zu entwickeln.
Fragen:
F: Ist Stickstofftrifluorid (NF3) polar?
A: Ja, NF3 ist polar. Es hat eine trigonal-pyramidale Molekülgeometrie mit dem Stickstoffatom im Zentrum und drei um ihn herum angeordneten Fluoratomen. Die asymmetrische Form des Moleküls führt zu einer ungleichmäßigen Verteilung der Elektronendichte, was zu einem polaren Molekül führt.
F: Wie lautet die Formel für Stickstofftrifluorid?
A: Die Formel für Stickstofftrifluorid lautet NF3, was bedeutet, dass das Molekül aus einem Stickstoffatom und drei Fluoratomen besteht.
F: Woher kommt Stickstofftrifluorid?
A: NF3 kann durch verschiedene Methoden hergestellt werden, einschließlich der Reaktion von wasserfreiem Ammoniak mit Fluorgas, thermischer Zersetzung von Ammoniumfluorid und elektrochemischer Synthese. Es wird häufig in der Halbleiterindustrie als Reinigungsmittel sowie bei der Herstellung elektronischer Komponenten und Triebwerke für die Luft- und Raumfahrt verwendet.
F: Lewis-Struktur von Stickstofftrifluorid?
A: Die Lewis-Struktur für NF3 besteht aus einem Stickstoffatom, das über einfache kovalente Bindungen mit drei Fluoratomen verbunden ist. Außerdem gibt es am Stickstoffatom ein Paar nichtbindender Elektronen, die dem Molekül die Form einer trigonalen Pyramide verleihen.
F: Intermolekulare Kräfte von Stickstofftrifluorid?
A: Zu den intermolekularen Kräften von NF3 gehören Dipol-Dipol-Wechselwirkungen, die aus der polaren Natur des Moleküls resultieren. Das Molekül experimentiert auch mit Londoner Dispersionskräften, bei denen es sich um schwache intermolekulare Kräfte handelt, die aus vorübergehenden Schwankungen der Elektronendichte resultieren.
F: Ist NF3 polar oder unpolar?
A: NF3 ist aufgrund seiner asymmetrischen Form und ungleichmäßigen Elektronendichteverteilung polar. Das Molekül hat ein Dipolmoment, was darauf hinweist, dass es ein positives und ein negatives Ende hat, was es zu einem polaren Molekül macht.
