Fluorantimonsäure ist eine der stärksten bekannten Supersäuren mit einer Hammett-Säurefunktion von -21. Es ist eine Mischung aus Fluorwasserstoff und Antimonpentafluorid.
| IUPAC-Name | Fluorantimonsäure (V) |
| Molekularformel | H[SbF6] |
| CAS-Nummer | 16950-06-4 |
| Synonyme | Wasserstoffhexafluorantimonat (V), hydratisiertes Antimonhexafluorid, Antimonhydrogenfluorid, Flusssäure mit Pentafluorantimon (1:1) |
| InChI | InChI=1S/F6Sb.H/h1H;/q+1;/p-1 |
pH-Wert von Fluorantimonsäure
Fluorantimonsäure ist eine Supersäure und hat einen pH-Wert unter -14. Dies liegt daran, dass die pH-Skala die Konzentration von Wasserstoffionen (H+) in einer Lösung misst und Supersäuren höhere Konzentrationen an H+-Ionen aufweisen als reines Wasser.
Herkömmliche pH-Meter können den pH-Wert von Fluorantimonsäure nicht genau messen, da sie nicht für den Umgang mit solch starken Säuren ausgelegt sind. Stattdessen verwenden Wissenschaftler die Hammett-Säurefunktion, um den Säuregehalt von Fluorantimonsäure zu messen. Die Hammett-Säurefunktion vergleicht den Säuregehalt von Supersäuren anhand des Protonierungsgrads einer Referenzverbindung. Fluorantimonsäure hat eine Hammett-Säurefunktion von -21, was den negativsten Wert darstellt und darauf hinweist, dass es sich um eine der stärksten bekannten Supersäuren handelt.
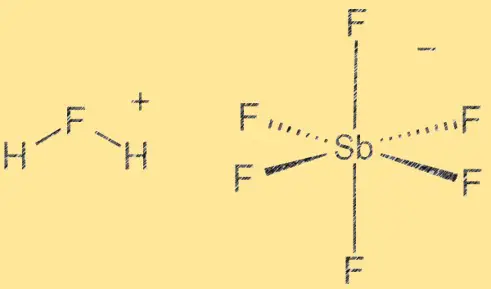
Struktur von Fluorantimonsäure:
Fluorantimonsäure hat eine Molekülstruktur, die aus einem Wasserstoffion (H+) und einem Hexafluorantimonat-Ion (V) ([SbF6]^-) besteht. Das SbF6-Ion fungiert als Lewis-Säure, während das H+-Ion als Bronsted-Säure fungiert. Aufgrund des Elektronegativitätsunterschieds zwischen Wasserstoff- und Fluoratomen ist die Verbindung stark polar. Die Bindung zwischen Antimon und Fluorid ist kovalent, während die Bindung zwischen Wasserstoff und Fluorid polar kovalent ist.
Molmasse von Fluorantimonsäure:
Fluorantimonsäure hat eine Molmasse von 216,74 g/mol. Es handelt sich um eine hochreaktive und korrosive Supersäure, die aus Fluorwasserstoff (HF) und Antimonpentafluorid (SbF5) besteht. Die hohe Molmasse der Fluorantimonsäure kann auf das Vorhandensein des Schweratoms Antimon in ihrer Molekülstruktur zurückgeführt werden.
Siedepunkt von Fluorantimonsäure:
HSbF6 ist eine hochreaktive und instabile Verbindung und hat daher keinen definierten Siedepunkt. Bei Temperaturen über -10 °C zersetzt es sich und setzt giftige Fluorwasserstoffdämpfe frei. Sein Siedepunkt wird auf etwa 20–30 °C geschätzt, dies ist jedoch kein nützlicher Parameter zur Beschreibung der Eigenschaften von HSbF6.
Schmelzpunkt von Fluorantimonsäure:
HSbF6 hat aufgrund seiner hochreaktiven Natur keinen genau definierten Schmelzpunkt. Es kann nur in flüssigem Zustand vorliegen und zerfällt beim Abkühlen auf niedrigere Temperaturen schnell. Es wird geschätzt, dass es sich bei etwa -90 °C zersetzt und giftige Dämpfe von Fluorwasserstoff und Antimonpentafluorid freisetzt.
Dichte von Fluorantimonsäure g/ml:
Die Dichte von HSbF6 beträgt 2,1 g/ml. Diese hohe Dichte kann auf das Vorhandensein schwerer Antimonatome in seiner Molekülstruktur zurückgeführt werden. Es ist eine stark ätzende und reaktive Verbindung und sollte mit äußerster Vorsicht gehandhabt werden. Die Dichte von HSbF6 erschwert zudem die Handhabung im Labor.
Molekulargewicht von Fluorantimonsäure:
Das Molekulargewicht von Fluorantimonsäure beträgt 236,76 g/mol. Es besteht aus einem Wasserstoffion, einem Antimonion und sechs Fluoridionen. Das hohe Molekulargewicht der Fluorantimonsäure kann auf das Vorhandensein des Schweratoms Antimon in ihrer Molekülstruktur zurückgeführt werden.
Fluorantimonsäure-Formel:
Die chemische Formel für Fluorantimonsäure lautet H[SbF6]. Es besteht aus einem Wasserstoffion (H+) und einem Hexafluorantimonat-Ion (V) ([SbF6]^-). Das [SbF6]^-Ion entsteht durch die Reaktion von Antimonpentafluorid (SbF5) mit Fluorwasserstoff (HF). Die Formel stellt das einfachste ganzzahlige Verhältnis der in der Verbindung vorhandenen Atome dar.
| Aussehen | Farblose bis hellgelbe Flüssigkeit |
| Spezifisches Gewicht | 2,1 g/ml |
| Farbe | Farblos bis hellgelb |
| Geruch | Geruchlos |
| Molmasse | 236,76 g/Mol |
| Dichte | 2,1 g/ml |
| Fusionspunkt | Zersetzt sich bei etwa -90°C |
| Siedepunkt | Zersetzt sich oberhalb von -10°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert heftig mit Wasser |
| Löslichkeit | Löslich in wasserfreiem HF, SbF5, SO2F2 und SO2ClF |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| PKa | -21 (Hammett-Säurefunktion) |
| pH-Wert | Weniger als -14 |
Hinweis: Fluorantimonsäure ist eine hochreaktive und ätzende Verbindung, die mit äußerster Vorsicht gehandhabt werden sollte. Seine physikalischen und chemischen Eigenschaften lassen sich aufgrund seiner instabilen Natur und der begrenzten Methoden, die zu seiner Manipulation zur Verfügung stehen, nur schwer genau messen. Die in dieser Tabelle aufgeführten Werte sind Schätzungen, die auf der verfügbaren Literatur basieren und möglicherweise nicht präzise sind.
Sicherheit und Gefahren von Fluorantimonsäure
Fluorantimonsäure ist eine äußerst gefährliche und stark ätzende Substanz, die erhebliche Gesundheits- und Sicherheitsrisiken birgt. Es ist ein starkes Oxidationsmittel, das heftig mit Wasser, organischen Verbindungen und sogar einigen Metallen reagieren kann. Bei Kontakt mit der Haut oder den Augen kann es schwere Verbrennungen und Gewebeschäden verursachen, und das Einatmen seiner Dämpfe kann Atemnot und Lungenschäden verursachen.
Geschultes Personal sollte mit Fluorantimonsäure in gut belüfteten und ordnungsgemäß ausgestatteten Labors mit Spezialausrüstung und Schutzkleidung umgehen. Die Aufsichtsbehörden regeln und begrenzen die Verwendung von Fluorantimonsäure streng, da diese möglicherweise schwere Verletzungen und Umweltschäden verursachen kann.
| Gefahrensymbole | Ätzend |
| Sicherheitsbeschreibung | Dämpfe nicht einatmen. Tragen Sie Handschuhe, Kleidung und Augen-/Gesichtsschutz. Kontakt mit Haut, Augen und Kleidung vermeiden. Nur unter einer Chemikalienhaube verwenden. |
| UN-Identifikationsnummern | UN3264 |
| HS-Code | 28111990 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | III |
| Toxizität | Sehr giftig und ätzend; kann bei Kontakt mit Haut oder Augen schwere Verbrennungen und Gewebeschäden verursachen, und das Einatmen seiner Dämpfe kann Atemnot und Lungenschäden verursachen. |
Methoden zur Synthese von Fluorantimonsäure
Fluorantimonsäure (HSbF6) wird üblicherweise durch Mischen von Fluorwasserstoff (HF) und Antimonpentafluorid (SbF5) im Molverhältnis 1:1 synthetisiert. Die Reaktion findet unter wasserfreien Bedingungen und bei niedrigen Temperaturen statt, um eine Zersetzung der entstehenden Supersäure zu verhindern. Die Gesamtreaktion lässt sich wie folgt darstellen:
HF + SbF5 → HSbF6
Die Reaktion ist stark exotherm und kann große Wärmemengen freisetzen. Daher erfolgt die Durchführung in der Regel in einer gut belüfteten und kontrollierten Umgebung, beispielsweise einem chemischen Abzug, unter Anwendung geeigneter Schutzmaßnahmen.
Zur Herstellung von HSbF6 kann Antimontrifluorid (SbF3) mit HF in Gegenwart eines Oxidationsmittels wie SbF5 oder Schwefeldioxiddifluorid (SO2F2) umgesetzt werden. Diese Reaktion erfordert wasserfreie Bedingungen und niedrige Temperaturen. Die Reaktion kann wie folgt ausgedrückt werden:
SbF3 + 3HF + SO2F2 → HSbF6 + SO2
HSbF6 ist eine hochreaktive und instabile Verbindung, die eine besondere Handhabung und Lagerung erfordert. Normalerweise wird es in luftdichten Behältern unter wasserfreien Bedingungen und bei niedrigen Temperaturen gelagert, um eine Zersetzung zu verhindern. Aufgrund seiner hohen Toxizität und Korrosivität sind bei der Arbeit mit HSbF6 geeignete Sicherheitsmaßnahmen und Schutzausrüstung unerlässlich.
Verwendung von Fluorantimonsäure
Fluorantimonsäure (HSbF6) ist eine der wirksamsten bekannten Supersäuren und hat ein breites Anwendungsspektrum in Industrie und Forschung. Hier sind einige der Verwendungsmöglichkeiten von Fluorantimonsäure:
- HSbF6 dient als Katalysator bei verschiedenen chemischen Reaktionen, einschließlich Alkylierungen, Isomerisierungen und Polymerisationen.
- Die petrochemische Industrie verwendet HSbF6 bei der Herstellung von Benzin mit hoher Oktanzahl und anderen Kohlenwasserstoffen.
- Forscher in der Pharmaindustrie nutzen HSbF6 als Katalysator bei der Synthese verschiedener pharmazeutischer Produkte, darunter antivirale und krebsbekämpfende Medikamente.
- HSbF6 findet Anwendung beim Ätzen und Reinigen elektronischer Komponenten wie Mikrochips und Halbleiter, die bei der Herstellung elektronischer Komponenten verwendet werden.
- Wissenschaftler nutzen HSbF6 als Forschungsinstrument in verschiedenen Bereichen der Chemie und Materialwissenschaften, einschließlich der Synthese neuer Materialien und der Untersuchung chemischer Reaktionen.
HSbF6 ist ein hochreaktiver und gefährlicher Stoff, der spezielle Handhabungs- und Schutzmaßnahmen erfordert. Es unterliegt strengen Vorschriften und sollte nur von geschultem Personal in gut ausgestatteten Laboren verwendet werden. Die mit HSbF6 verbundenen potenziellen Gefahren beschränken seinen Einsatz auf spezielle Anwendungen, für die keine anderen Alternativen verfügbar sind.
Fragen:
Kann Fluorantimonsäure Diamant auflösen?
HSbF6 kann aufgrund seiner stark sauren Eigenschaften Diamanten auflösen. Geschultes Fachpersonal in gut ausgestatteten Labors mit entsprechenden Sicherheitsmaßnahmen und Schutzausrüstung kann die sehr gefährliche Reaktion zwischen Diamant und HSbF6 durchführen. Es handelt sich jedoch nicht um eine praktische oder kostengünstige Methode zur Bearbeitung oder zum Schneiden von Diamanten. Aufgrund ihrer Effizienz und Sicherheit werden mechanisches Schneiden oder Laserschneiden weitaus häufiger eingesetzt.
Wo kann man Fluorantimonsäure kaufen?
Der Kauf von HSbF6 ist aufgrund seiner äußerst gefährlichen und regulierten Natur äußerst schwierig. Nur zugelassene und autorisierte Unternehmen oder Institutionen mit den erforderlichen Genehmigungen und Geräten dürfen Säure sicher handhaben und lagern.
Das Chemiewaffenübereinkommen (CWC) und die US-amerikanischen Chemical Facilities Anti-Terrorism Standards (CFATS) klassifizieren HSbF6 als gefährliche und kontrollierte Substanz.
Regierungsbehörden wie die Environmental Protection Agency (EPA), das Department of Homeland Security (DHS) und das Bureau of Industry and Security (BIS) regeln und kontrollieren den Verkauf und Kauf von HSbF6 streng.
Wenn Sie einen berechtigten Bedarf an HSbF6 haben, können Sie sich an zugelassene Chemikalienlieferanten oder Forschungsinstitute mit den erforderlichen Genehmigungen und Fachkenntnissen wenden.
Sie müssen jedoch vor jedem Kauf eine ausführliche Begründung vorlegen und die erforderlichen Genehmigungen und Genehmigungen einholen.
