Wasserstoffperoxid oder H2O2 ist eine blassblaue Flüssigkeit mit stark oxidierenden Eigenschaften. Es wird häufig als Desinfektionsmittel, Bleichmittel und in Raketen als Treibmittel verwendet. In hohen Konzentrationen kann es schädlich sein.
| IUPAC-Name | Dihydrogendioxid |
| Molekularformel | H2O2 |
| CAS-Nummer | 7722-84-1 |
| Synonyme | Wasserstoffdioxid, Peroxid, Oxydol, Superoxol, Hydroniumdioxid, Peroxan, Asepticper usw. |
| InChI | InChI=1S/H2O2/c1-2/h1-2H |
Eigenschaften von Wasserstoffperoxid
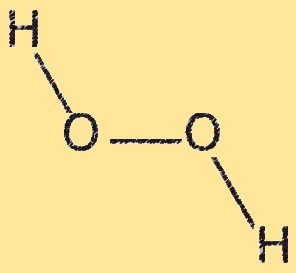
H2O2-Struktur
Wasserstoffperoxid hat eine gekrümmte Molekülstruktur mit einem Winkel von etwa 104,5 Grad zwischen den beiden Sauerstoffatomen. Das Molekül hat zwei OH-Bindungen und eine OO-Bindung. Die OO-Bindung ist schwach und lässt sich leicht aufbrechen, was Wasserstoffperoxid zu einem starken Oxidationsmittel macht. Die gekrümmte Struktur von Wasserstoffperoxid resultiert aus der Abstoßung zwischen freien Elektronenpaaren an Sauerstoffatomen.
Wasserstoffperoxid-Formel
Die chemische Formel für Wasserstoffperoxid lautet H2O2, was bedeutet, dass jedes Wasserstoffperoxidmolekül zwei Wasserstoffatome und zwei Sauerstoffatome enthält. Die Formel ist eine prägnante Möglichkeit, die molekulare Zusammensetzung einer Substanz darzustellen. Die chemische Formel von Wasserstoffperoxid ist wichtig für das Verständnis seiner Eigenschaften und seiner Reaktionen mit anderen Substanzen.
Molmasse von Wasserstoffperoxid
Wasserstoffperoxid hat eine Molmasse von etwa 34,01 g/mol. Die Molmasse ist die Summe der Atommassen aller Atome in einem Molekül der Verbindung. Wasserstoffperoxid hat zwei Wasserstoffatome und zwei Sauerstoffatome in jedem Molekül, daher wird seine Molmasse durch Addition der Atommasse jedes Atoms berechnet. Die Molmasse ist eine wichtige Eigenschaft einer Substanz, da sie bei stöchiometrischen Berechnungen zur Bestimmung der in einer bestimmten Probe vorhandenen Substanzmenge verwendet wird.
Siedepunkt von Wasserstoffperoxid
Der Siedepunkt von Wasserstoffperoxid beträgt 150,2 °C (302,4 °F). Diese Temperatur ist der Punkt, an dem der Dampfdruck der Flüssigkeit dem Atmosphärendruck entspricht. Oberhalb dieser Temperatur geht die Flüssigkeit in einen Gaszustand über, unterhalb dieser Temperatur verbleibt sie im flüssigen Zustand. Der Siedepunkt von Wasserstoffperoxid ist aufgrund der Anwesenheit intermolekularer Wasserstoffbrückenbindungen in Wasserstoffperoxid höher als der von Wasser, das bei 100 °C siedet.
Schmelzpunkt von Wasserstoffperoxid
Der Schmelzpunkt von Wasserstoffperoxid beträgt -0,43 °C (31,23 °F). Diese Temperatur ist der Punkt, an dem sich der feste und flüssige Zustand eines Stoffes im Gleichgewicht befindet. Bei dieser Temperatur schmilzt die feste Form von Wasserstoffperoxid zu einer Flüssigkeit. Der Schmelzpunkt von Wasserstoffperoxid ist aufgrund der instabilen Natur des Wasserstoffperoxidmoleküls niedriger als der von Wasser, das bei 0 °C schmilzt.
Dichte von Wasserstoffperoxid g/ml
Die Dichte von Wasserstoffperoxid beträgt 1,11 g/ml bei Standardtemperatur und -druck (STP). Das bedeutet, dass ein Milliliter Wasserstoffperoxid 1,11 Gramm wiegt. Die Dichte von Wasserstoffperoxid ist aufgrund der Anwesenheit schwererer Sauerstoffatome im Wasserstoffperoxid größer als die von Wasser, das eine Dichte von 1 g/ml hat.
Molekulargewicht von Wasserstoffperoxid
Das Molekulargewicht von Wasserstoffperoxid beträgt 34,01 g/mol. Dieser Wert wird berechnet, indem die Atommassen jedes Atoms in einem Wasserstoffperoxidmolekül addiert werden. Das Molekulargewicht ist eine wichtige Eigenschaft einer Substanz, da es in verschiedenen Berechnungen verwendet wird, einschließlich der Bestimmung der Konzentration von Wasserstoffperoxid in einer Lösung.
| Aussehen | Klare, farblose Flüssigkeit |
| Spezifisches Gewicht | 1,11 g/cm3 bei 20°C |
| Farbe | Hellblau (reine Form) |
| Geruch | Nahezu geruchlos (reine Form) |
| Molmasse | 34,01 g/Mol |
| Dichte | 1,11 g/ml bei 20 °C |
| Fusionspunkt | -0,43°C |
| Siedepunkt | 150,2°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Vollständig mit Wasser mischbar |
| Löslichkeit | Löslich in Alkohol, Ether und anderen organischen Lösungsmitteln |
| Dampfdruck | 23,3 mmHg bei 20°C |
| Wasserdampfdichte | 1,1 (Luft = 1) |
| pKa | 11,6 (bei 25°C) |
| pH-Wert | 4,5 – 6,0 (10 %ige Lösung) |
Hinweis: Diese Werte sind typische Werte und können je nach Reinheit, Konzentration und anderen Faktoren variieren.
Sicherheit und Gefahren von Wasserstoffperoxid
Wasserstoffperoxid kann bei falscher Handhabung gefährlich sein. Es handelt sich um ein starkes Oxidationsmittel, das heftig mit organischen und anorganischen Substanzen reagieren und möglicherweise einen Brand oder eine Explosion verursachen kann. Auch die konzentrierte Form von Wasserstoffperoxid ist ätzend und kann bei Haut- oder Augenkontakt schwere Verbrennungen oder Gewebeschäden verursachen. Das Einatmen von Wasserstoffperoxiddämpfen kann zu Reizungen der Atemwege führen und der Verzehr kann zu schweren inneren Schäden oder zum Tod führen. Daher sollten beim Umgang mit Wasserstoffperoxid entsprechende Sicherheitsvorkehrungen getroffen werden, wie das Tragen von Schutzkleidung und Handschuhen, die Vermeidung des Kontakts mit unverträglichen Substanzen und die Verwendung in einem gut belüfteten Bereich.
| Gefahrensymbole | O,C |
| Sicherheitsbeschreibung | Von Hitze, Funken und Flammen fernhalten. Tragen Sie Schutzkleidung und Handschuhe. Kontakt mit Haut, Augen und Kleidung vermeiden. Dämpfe nicht einatmen. Im Brandfall Wassersprühstrahl, Schaum, Trockenlöschmittel oder Kohlendioxid verwenden. |
| UN-Identifikationsnummern | UN2015 |
| HS-Code | 2847.00.00 |
| Gefahrenklasse | 5.1 |
| Verpackungsgruppe | II |
| Toxizität | Giftig bei Verschlucken oder Einatmen. Verursacht schwere Hautverbrennungen und Augenschäden. Kann Reizungen der Atemwege verursachen. Kann einen Brand oder eine Explosion verursachen. |
Methoden zur Wasserstoffperoxid-Synthese
Wasserstoffperoxid kann durch verschiedene Methoden synthetisiert werden, darunter das Anthrachinon-Verfahren, die Autoxidation von 2-Ethylanthrahydrochinon und die Elektrolyse verdünnter Schwefelsäure . Die gebräuchlichste Methode zur kommerziellen Herstellung von Wasserstoffperoxid ist das Anthrachinon-Verfahren.
Beim Anthrachinon-Verfahren wird Anthrachinon zunächst zu Anthrahydrochinon hydriert, das dann mit Luft in Gegenwart eines Katalysators zu Wasserstoffperoxid oxidiert wird. Anschließend wird das Wasserstoffperoxid mithilfe verschiedener Techniken wie Destillation und Filtration extrahiert und gereinigt.
Eine weitere Methode zur Synthese von Wasserstoffperoxid ist die Autoxidation von 2-Ethylanthrahydrochinon. Bei dieser Methode wird 2-Ethylanthrahydrochinon in Gegenwart eines alkalischen Katalysators der Luft ausgesetzt, was die Autoxidation der Verbindung unter Bildung von Wasserstoffperoxid fördert.
Die Elektrolyse verdünnter Schwefelsäure ist eine weitere Methode zur Synthese von Wasserstoffperoxid. Bei dieser Methode wird verdünnte Schwefelsäure mithilfe einer speziellen Elektrolysezelle elektrolysiert, wodurch an einer der Elektroden Wasserstoffperoxid erzeugt wird.
Wasserstoffperoxid kann auch auf andere Weise synthetisiert werden, beispielsweise durch direkte Synthese aus Wasserstoff und Sauerstoff oder durch Reduktion von Peroxiden mit Reduktionsmitteln. Aufgrund ihrer geringen Effizienz und Sicherheitsbedenken werden diese Methoden jedoch üblicherweise nicht für die kommerzielle Herstellung von Wasserstoffperoxid eingesetzt.
Verwendungsmöglichkeiten von Wasserstoffperoxid
Wasserstoffperoxid ist eine vielseitige chemische Verbindung mit einem breiten Anwendungsspektrum in verschiedenen Branchen. Hier sind einige häufige Verwendungszwecke für Wasserstoffperoxid:
- In der Textil-, Papier- und Zellstoffindustrie wird häufig H2O2 als Bleichmittel verwendet, um Farbe aus Stoffen und Zellstoff zu entfernen.
- Gesundheitseinrichtungen nutzen H2O2 als wirksames Desinfektionsmittel, um Bakterien, Viren und Pilze abzutöten und medizinische Geräte und Oberflächen zu sterilisieren.
- Wasseraufbereitungsanlagen nutzen H2O2, um Verunreinigungen wie Eisen und Mangan zu entfernen und Wasser zu desinfizieren.
- Haarfärbemittel und Zahnaufhellungsprodukte verwenden H2O2, um die Farbe von Haaren und Zähnen aufzuhellen.
- Die Luft- und Raumfahrtindustrie verwendet H2O2 als Raketentreibstoff.
- Bei der Herstellung verschiedener Polymere wie Polypropylen, Polyethylen und Polystyrol kommt H2O2 zum Einsatz.
- H2O2 ist ein Reinigungsmittel, das zum Entfernen von Flecken und Schmutz von Oberflächen und zum Reinigen von Kontaktlinsen geeignet ist.
- H2O2 wird in der Lebensmittelindustrie als Bleichmittel und Konservierungsmittel für Lebensmittelprodukte verwendet.
Insgesamt macht die Vielseitigkeit von H2O2 es zu einer wertvollen chemischen Verbindung mit vielen Anwendungen in verschiedenen Branchen.
Fragen:
Preis für Wasserstoffperoxid
Der Preis von Wasserstoffperoxid kann je nach verschiedenen Faktoren wie Reinheit, Konzentration und Kaufmenge stark variieren. Im Allgemeinen kann der Preis für Wasserstoffperoxid zwischen wenigen Cent pro Pfund für technisches Wasserstoffperoxid und mehreren Dollar pro Pfund für hochreine Qualitäten für Spezialanwendungen liegen.
Im Februar 2023 lag der Durchschnittspreis für 35 %iges Wasserstoffperoxid in Lebensmittelqualität bei etwa 20 bis 30 US-Dollar pro Gallone oder 0,10 bis 0,20 US-Dollar pro Flüssigunze. Wasserstoffperoxid in Industriequalität mit geringerer Reinheit und Konzentration kostet möglicherweise weniger, normalerweise zwischen 1 und 5 US-Dollar pro Gallone. Allerdings können die Preise je nach Anbieter, Region und anderen Faktoren variieren.
Wo kann man Wasserstoffperoxid kaufen?
Wasserstoffperoxid ist eine gängige chemische Verbindung, die bei verschiedenen Anbietern sowohl online als auch in Geschäften erworben werden kann. Hier sind einige Orte, an denen Sie Wasserstoffperoxid kaufen können:
- Chemielieferanten: Chemielieferanten wie Sigma-Aldrich, Fisher Scientific und VWR International bieten eine breite Palette an Qualitäten und Konzentrationen von Wasserstoffperoxid für verschiedene Anwendungen an.
- Online-Marktplätze: Online-Marktplätze wie Amazon, eBay und Alibaba bieten Wasserstoffperoxid von verschiedenen Anbietern in unterschiedlichen Qualitäten und Konzentrationen an.
- Lebensmittelgeschäfte und Apotheken: Viele Lebensmittelgeschäfte und Apotheken verkaufen Wasserstoffperoxid in niedriger Konzentration (3 % bis 6 %) als Antiseptikum zur Wundreinigung und Ersten Hilfe.
- Geschäfte für Poolbedarf: Wasserstoffperoxid kann als Pool- und Spa-Oxidationsmittel verwendet werden, um die Klarheit und Desinfektion des Wassers aufrechtzuerhalten. Poolzubehörgeschäfte wie Leslie’s Pool Supplies führen zu diesem Zweck möglicherweise Wasserstoffperoxidprodukte.
