Ammoniumoxid ((NH4)2O) ist eine weiße kristalline Verbindung, die in Wasser löslich ist und als schwache Base fungiert. Es entsteht durch die Reaktion von Ammoniak und Sauerstoff und wird in Düngemitteln, Reinigungsmitteln und als Feuerlöscher verwendet.
| IUPAC-Name | Ammoniumoxid |
| Molekularformel | (NH4)2O |
| CAS-Nummer | 12046-03-6 |
| Synonyme | Ammoniumhydroxid, Ammoniaklösung, Aqua Ammoniak |
| InChI | InChI=1S/H4N.O/h1H4;/q+1;-1 |
Eigenschaften von Ammoniumoxid
Ammoniumoxid-Formel
Die Formel für Ammoniumoxid lautet (NH4)2O. Es ist eine Verbindung, die aus einem Stickstoffatom und vier Wasserstoffatomen in Kombination mit einem Sauerstoffatom besteht.
Ammoniumoxid-Molmasse
Die Molmasse von Ammoniumoxid beträgt etwa 52,07 Gramm pro Mol. Sie wird durch Addition der Atomgewichte aller im Molekül vorhandenen Atome berechnet. Die Molmasse hilft dabei, die Anzahl der Partikel zu bestimmen, die in einer bestimmten Menge einer Substanz vorhanden sind.
Siedepunkt von Ammoniumoxid
Der Siedepunkt von (NH4)2O liegt bei etwa 90°C. Dabei handelt es sich um die Temperatur, bei der der Dampfdruck einer Flüssigkeit dem Druck um sie herum entspricht und die Flüssigkeit dadurch in ein Gas übergeht. Der Siedepunkt eines Stoffes ist eine wichtige physikalische Eigenschaft, die zur Identifizierung und Unterscheidung verschiedener Verbindungen verwendet werden kann.
Schmelzpunkt von Ammoniumoxid
Der Schmelzpunkt von (NH4)2O liegt bei etwa -6°C. Dies ist die Temperatur, bei der ein Feststoff flüssig wird. Der Schmelzpunkt einer Substanz kann zur Identifizierung und Unterscheidung verschiedener Verbindungen sowie zur Bestimmung der Reinheit einer Substanz verwendet werden.
Dichte von Ammoniumoxid g/ml
Die Dichte von (NH4)2O beträgt etwa 1,02 g/ml. Die Dichte ist die Menge an Masse pro Volumeneinheit und eine grundlegende physikalische Eigenschaft eines Stoffes. Die Dichte einer Substanz kann zur Identifizierung und Unterscheidung verschiedener Verbindungen sowie zur Bestimmung der Reinheit einer Substanz verwendet werden.
Molekulargewicht von Ammoniumoxid
Das Molekulargewicht von Ammoniumoxid beträgt etwa 52,07 g/mol. Es ist die Summe der Atomgewichte aller in einem Molekül der Substanz vorhandenen Atome. Das Molekulargewicht kann zur Berechnung der Mole einer Substanz in einer bestimmten Masse verwendet werden und ist eine wichtige physikalische Eigenschaft, die in vielen Bereichen der Wissenschaft verwendet wird.
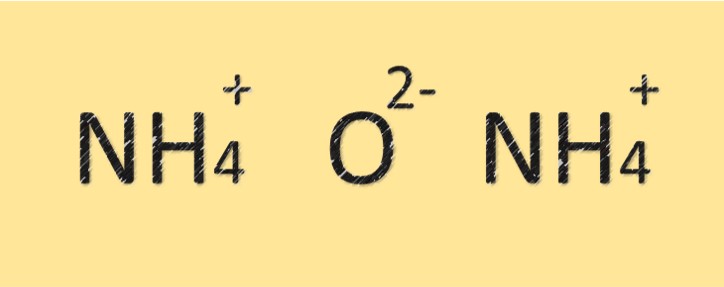
Struktur von Ammoniumoxid
Ammoniumoxid ist eine Verbindung aus Stickstoff- und Sauerstoffatomen. Es hat die Summenformel (NH4)2O und besteht aus zwei Stickstoffatomen und einem Sauerstoffatom. Das Stickstoffatom ist durch eine kovalente Bindung mit dem Sauerstoffatom verbunden und trägt ebenfalls eine positive Ladung. Aufgrund des Vorhandenseins des Ammoniumions hat die Verbindung einen basischen oder alkalischen Charakter.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 1,02 g/cm³ |
| Farbe | Weiß |
| Geruch | Ammoniak |
| Molmasse | 52,07 g/Mol |
| Dichte | 1,02 g/cm³ |
| Fusionspunkt | -6°C |
| Siedepunkt | 90°C |
| Blitzpunkt | N / A |
| Löslichkeit in Wasser | Löslich |
| Löslichkeit | In Wasser löslich |
| Dampfdruck | N / A |
| Wasserdampfdichte | N / A |
| pKa | N / A |
| pH-Wert | 11,6 (100 g/L, H2O, 20°C) |
Sicherheit und Gefahren von Ammoniumoxid
(NH4)2O reizt Augen, Haut und Atemwege. Das Einatmen der Dämpfe kann zu Husten, Kurzatmigkeit und Lungenreizungen führen. Bei Hautkontakt kann es zu Juckreiz und Rötungen kommen. Die Verbindung sollte mit Vorsicht gehandhabt werden und Schutzmaßnahmen wie Handschuhe und Augenschutz sollten verwendet werden. Bei Exposition sollten die betroffenen Bereiche mit Wasser gespült werden und bei anhaltenden Symptomen ein Arzt aufgesucht werden. Es ist außerdem brennbar und sollte von Zündquellen ferngehalten werden.
| Gefahrensymbole | Reizend |
| Sicherheitsbeschreibung | S26-S36/37/39 |
| UN-Identifikationsnummern | UN2672 |
| HS-Code | 2841.90.90 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | III |
| Toxizität | Reizt Augen, Haut und Atemwege |
Methoden zur Synthese von Ammoniumoxid
(NH4)2O kann durch verschiedene Methoden synthetisiert werden, einschließlich der thermischen Zersetzung von Ammoniumnitrat und der Reaktion zwischen Ammoniakgas und Sauerstoffgas.
Eine Methode beinhaltet die thermische Zersetzung von Ammoniumnitrat, einem üblichen Düngemittel. Bei der Reaktion entstehen Ammoniak und Stickstoffdioxid, die dann zu Stickstoffdioxid und Stickoxid oxidiert werden. Stickoxid reagiert mit mehr Ammoniakgas unter Bildung von (NH4)2O.
Eine andere Methode besteht darin, Ammoniakgas über einen erhitzten Katalysator zu leiten, wodurch sich die Stickstoff- und Sauerstoffatome verbinden und (NH4)2O bilden. Bei beiden Methoden entsteht (NH4)2O als weißer kristalliner Feststoff, der durch Umkristallisation gereinigt werden kann.
Verwendung von Ammoniumoxid
Aufgrund seines hohen Ammoniumgehalts und seiner starken alkalischen Eigenschaften wird (NH4)2O in der Industrie für verschiedene Zwecke verwendet. Als Dünger dient es den Pflanzen als Stickstoffquelle. Reinigungsmittel lösen damit Fett und Schmutz. Die metallurgische Industrie nutzt es als Reduktionsmittel für Metalloxide, insbesondere bei der Herstellung von Aluminium. Als Kältemittel wird es in industriellen Kühlsystemen und als Stickstoffquelle bei der Herstellung von Salpetersäure eingesetzt. Im Labor nutzen Chemiker es als Ammoniakquelle für chemische Reaktionen. Die Vielseitigkeit von (NH4)2O macht es zu einer wertvollen Chemikalie mit vielfältigen Anwendungen in allen Sektoren.
