Natriumcarbonat oder Natriumcarbonat ist eine anorganische Verbindung mit der chemischen Formel Na2CO3. Es ist ein alkalisches Salz, weiß gefärbt und wasserlöslich. Es wird in vielen industriellen und kommerziellen Prozessen eingesetzt, beispielsweise bei der Herstellung von Glas, Papier, Seifen, Wasch- und Reinigungsmitteln.
| IUPAC-Name | Natriumcarbonat |
| Molekularformel | Na2CO3 |
| CAS-Nummer | 497-19-8 |
| Synonyme | Wasserfreies Na2CO3, dekahydratisiertes Na2CO3, Waschsoda, Natriumcarbonat |
| InChI | InChI=1S/2Na.CO3/c21-3(2)4;/h2(H,1,2,3,4);/q;;+2/p-2 |
Eigenschaften von Natriumcarbonat
Molmasse von Natriumcarbonat
Die Molmasse von Natriumcarbonat beträgt 106,0 g/mol. Es ist die Summe der Atommassen aller Atome in einem Natriumcarbonat-Molekül. Die Molmasse ist eine wichtige physikalische Eigenschaft, die in vielen Berechnungen in der Chemie und anderen Wissenschaften verwendet wird.
Siedepunkt von Natriumcarbonat
Natriumcarbonat hat einen Siedepunkt von 1600 °C. Dies ist die Temperatur, bei der der Dampfdruck der Flüssigkeit dem Druck der umgebenden Atmosphäre entspricht und die Flüssigkeit siedet. Der Siedepunkt ist eine nützliche Eigenschaft zur Identifizierung und Trennung verschiedener Verbindungen.
Schmelzpunkt von Natriumcarbonat
Na2CO3 hat einen Schmelzpunkt von 851°C. Dies ist die Temperatur, bei der die feste Form der Verbindung in eine Flüssigkeit übergeht. Der Schmelzpunkt ist eine wichtige Eigenschaft, die bei der Identifizierung und Reinigung verschiedener Substanzen verwendet wird.
Dichte von Natriumcarbonat g/ml
Na2CO3 hat eine Dichte von 2,54 g/ml. Die Dichte ist definiert als die Masse pro Volumeneinheit einer Substanz und ist eine nützliche Eigenschaft zur Bestimmung der Konzentration einer Lösung.
Molekulargewicht von Natriumcarbonat
Das Molekulargewicht von Natriumcarbonat beträgt 106 g/mol. Es ist die Summe der Atomgewichte aller Atome in einem Molekül. Das Molekulargewicht ist eine wichtige Eigenschaft, die bei vielen Berechnungen in der Chemie und anderen Wissenschaften verwendet wird.
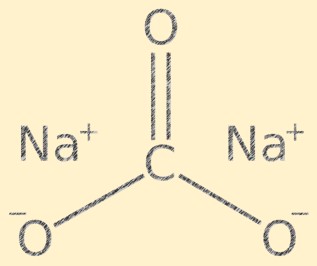
Struktur von Natriumcarbonat
Na2CO3 hat eine Kristallstruktur und besteht aus Natriumkationen (Na+) und Carbonatanionen (CO3-). Das Carbonation hat eine trigonal-ebene Form, mit dem Kohlenstoffatom in der Mitte und den Sauerstoffatomen, die in einem Winkel von 120 Grad daran befestigt sind. Die Natriumionen und Carbonationen werden durch Ionenbindungen zusammengehalten und verleihen der Verbindung ihre charakteristische Kristallstruktur.
| Aussehen | Weißes kristallines Pulver oder kleine weiße Kristalle |
| Spezifisches Gewicht | 2,54 g/cm³ |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 106,0 g/Mol |
| Dichte | 2,54 g/ml |
| Fusionspunkt | 851°C |
| Siedepunkt | 1600°C |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | In Wasser löslich |
| Löslichkeit | Löslich in Glycerin, schwer löslich in Ethanol |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | 10.3 |
| pH-Wert | 11.6 (1M-Lösung) |
Sicherheit und Gefahren von Natriumcarbonat
Natriumcarbonat ist eine basische Verbindung und kann Haut- und Augenreizungen verursachen. Das Einatmen des Staubes kann zu Reizungen der Atemwege führen. Außerdem ist es beim Verschlucken schädlich und kann zu Verdauungsstörungen führen. Die Handhabung sollte mit Handschuhen und Schutzbrille erfolgen und der Stoff sollte an einem kühlen, trockenen Ort, entfernt von Zündquellen, gelagert werden. Vermeiden Sie das Verschlucken oder Einatmen des Pulvers und waschen Sie es nach der Handhabung gründlich.
| Gefahrensymbole | XI, N |
| Sicherheitsbeschreibung | Reizend |
| UN-Identifikationsnummern | Ein 1824 |
| HS-Code | 2836.90.90 |
| Gefahrenklasse | 8 |
| Verpackungsgruppe | III |
| Toxizität | Oraler LD50 (Ratte) = 915 mg/kg. Inhalation LC50 (Ratte) = >10 mg/L/4h. Kann beim Einatmen Haut- und Augenreizungen sowie Reizungen der Atemwege verursachen. Kann beim Verschlucken gesundheitsschädlich sein. |
Methoden zur Synthese von Natriumcarbonat
Natriumcarbonat kann nach zwei Hauptmethoden synthetisiert werden: dem Solvay-Verfahren und der Fällungsmethode. Der Solvay-Prozess, auch Ammoniak-Soda-Prozess genannt, beinhaltet die Reaktion von Natriumchlorid, Ammoniak und Kohlendioxid zu Natriumcarbonat, Ammoniumchlorid und Wasser. Bei der Fällungsmethode erfolgt die Reaktion von Natriumhydroxid und Kohlendioxid zur Bildung von Natriumcarbonat und Wasser. Beide Methoden führen zu einem hochreinen Produkt, das für verschiedene Anwendungen wie Wasseraufbereitung, Seifen- und Waschmittelherstellung sowie Glasproduktion verwendet werden kann. Aufgrund der geringeren Produktionskosten und der höheren Produktionsausbeute ist das Solvay-Verfahren das am häufigsten verwendete Verfahren.
Verwendung von Natriumcarbonat
Die Industrie verwendet Natriumcarbonat oder Waschsoda für verschiedene Zwecke. Die Waschmittelindustrie nutzt es als Wasserenthärter und pH-Regler, die Glasindustrie nutzt es zur Herstellung von Flachglas, Verpackungsglas und Spezialglas und die Papierindustrie nutzt es zur Neutralisierung saurer Abfallströme und zur Regulierung des pH-Werts. In der chemischen Industrie ist Natriumcarbonat ein wichtiger Bestandteil bei der Herstellung von Natriumsilikaten und -bicarbonaten. Darüber hinaus dient es als Lebensmittelzusatzstoff und Reinigungsmittel in Kesseln und Wasseraufbereitungsprozessen in der Lebensmittelindustrie. Darüber hinaus spielt Natriumcarbonat eine Rolle bei der Herstellung von Farbstoffen, Emails und Keramik und fungiert in Feuerlöschern als Feuerlöscher.
