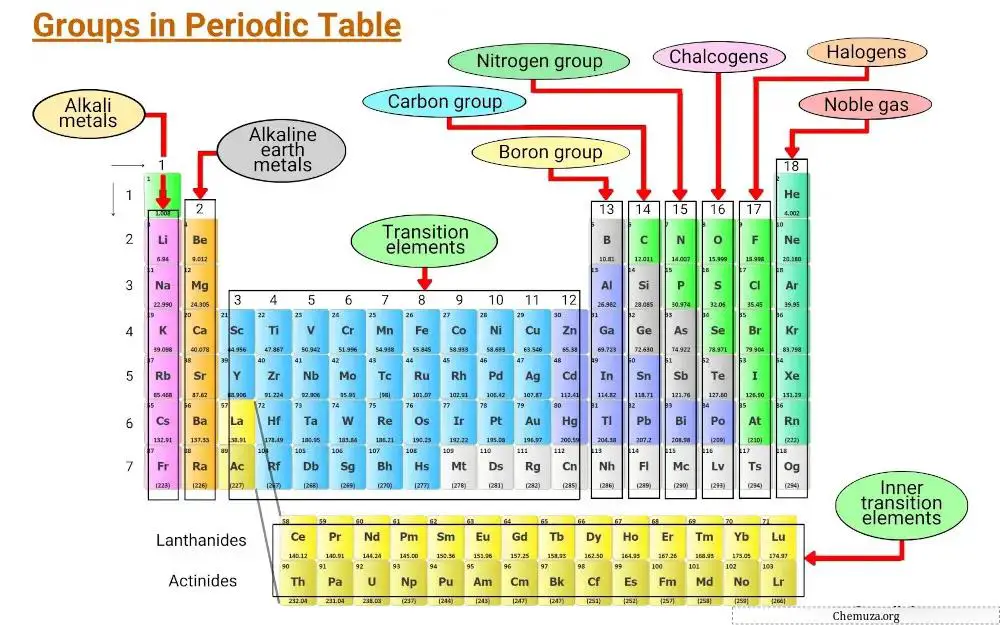
Elemente werden nach gemeinsamen Merkmalen gruppiert, einschließlich elektronischer Konfigurationen und dem Verhalten von Valenzelektronen.
Die vertikalen Spalten des Periodensystems werden Gruppen genannt, und es gibt 18 Gruppen im Periodensystem, jede mit ihren eigenen Eigenschaften, die bestimmen, wie ein Element mit anderen Elementen interagiert und Verbindungen bildet.
In diesem Artikel werden wir die verschiedenen Gruppen im Periodensystem untersuchen.
Kommen wir gleich zur Sache!.
Gruppe 1: Alkalimetalle
Gruppe 1 des Periodensystems wird als Alkalimetalle bezeichnet.
Zu dieser Gruppe gehören Lithium, Natrium, Kalium, Rubidium, Cäsium und Francium.
Alkalimetalle sind für ihre Weichheit, ihren niedrigen Schmelzpunkt und ihre hohe Reaktivität mit Wasser und Luft bekannt.
Alkalimetalle sind sehr reaktiv, da sie in ihrer äußersten Schale nur ein Elektron haben, das sie leicht abgeben, um positive Ionen zu bilden. [1]
Dies macht sie zu hervorragenden Stromleitern und nützlich in vielen Anwendungen, einschließlich Batterien und industriellen Prozessen.
Aufgrund ihrer hohen Reaktivität müssen Alkalimetalle jedoch vorsichtig gehandhabt werden. Sie können sich an der Luft spontan entzünden und mit Wasser explosionsartig reagieren, wobei Wasserstoffgas freigesetzt wird. [2]
Gruppe 2: Erdalkalimetalle
Gruppe 2 des Periodensystems ist als „ Erdalkalimetalle “ bekannt. Zu dieser Gruppe gehören sechs Elemente: Beryllium, Magnesium, Kalzium, Strontium, Barium und Radium.
Diese Metalle werden „alkalisch“ genannt, weil sie mit Wasser unter Bildung alkalischer (basischer) Lösungen reagieren.
Erdalkalimetalle haben ähnliche Eigenschaften, darunter hohe Schmelz- und Siedepunkte, niedrige Dichten und die Fähigkeit, leicht Ionen mit einer Ladung von +2 zu bilden.
Sie sind außerdem sehr reaktiv, insbesondere gegenüber Wasser und Sauerstoff. Im Gegensatz zu Alkalimetallen der Gruppe 1 sind sie jedoch weniger reaktiv und haben einen höheren Schmelzpunkt.
Diese Elemente kommen in vielen Alltagsgegenständen vor, darunter Knochen (Kalzium), Feuerwerkskörper (Strontium) und Flugzeugteile (Magnesium).
Erdalkalimetalle werden auch in industriellen Prozessen verwendet, beispielsweise bei der Herstellung von Aluminium und Stahl.
Gruppe 3 – 11: Übergangsmetalle
Die Gruppen 3 bis 11 des Periodensystems werden als Übergangsmetallgruppe bezeichnet. Diese Metalle haben einzigartige Eigenschaften, die sie von anderen Gegenständen auf dem Tisch unterscheiden.
Eine der charakteristischen Eigenschaften von Übergangsmetallen ist ihre Fähigkeit, farbige Verbindungen zu bilden.
Dies liegt an ihrer einzigartigen elektronischen Konfiguration, die es ihnen ermöglicht, bestimmte Lichtwellenlängen zu absorbieren und zu reflektieren. [3]
Übergangsmetalle sind außerdem für ihren hohen Schmelz- und Siedepunkt sowie ihre Festigkeit und Haltbarkeit bekannt.
Sie werden häufig in Baumaterialien, elektrischen Leitungen und sogar Schmuck verwendet.
Gruppe 13: Borgruppe
Gruppe 13 des Periodensystems ist als Borgruppe bekannt und umfasst die Elemente Bor (B), Aluminium (Al), Gallium (Ga), Indium (In), Thallium (Tl) und Nihonium (Nh).
Diese Elemente haben bestimmte Eigenschaften gemeinsam, die sie chemisch ähnlich machen.
Bor ist das einzige Metalloid in dieser Gruppe, was bedeutet, dass es sowohl metallische als auch nichtmetallische Eigenschaften besitzt.
Gruppe 14: Kohlenstoffgruppe
Gruppe 14 des Periodensystems ist als Kohlenstoffgruppe bekannt und umfasst Kohlenstoff (C), Silizium (Si), Germanium (Ge), Zinn (Sn), Blei (Pb) und Flerovium (Fl).
Diese Elemente haben ähnliche Eigenschaften, da sie alle über vier Valenzelektronen verfügen.
Kohlenstoff ist ein sehr wichtiges Element, da es die Grundlage aller organischen Moleküle bildet, einschließlich der Bausteine des Lebens wie Proteine und DNA. [4]
Gruppe 15: Pniktogene
Gruppe 15 des Periodensystems wird auch als Stickstoffgruppe (oder Pniktogene) bezeichnet.
Diese Gruppe enthält 6 Elemente: Stickstoff (N), Phosphor (P), Arsen (As), Antimon (Sb), Wismut (Bi) und Moscovium (Mc).
Elemente der Gruppe 15 haben fünf Valenzelektronen in ihrer äußersten Elektronenhülle, was bedeutet, dass sie dazu neigen, drei kovalente Bindungen zu bilden, um ihr Oktett zu vervollständigen.
Sie neigen auch dazu, drei Elektronen aufzunehmen, um Anionen zu bilden. Elemente werden in der Gruppe weniger nichtmetallisch und metallischer.
Gruppe 16: Chalkogene
Die Gruppe 16 des Periodensystems wird als Sauerstoffgruppe bezeichnet. Es umfasst die Elemente Sauerstoff (O), Schwefel (S), Selen (Se), Tellur (Te), Polonium (Po) und Leber (Lv).
Diese Elemente haben bestimmte Eigenschaften gemeinsam, darunter das Vorhandensein von sechs Valenzelektronen in ihrem äußersten Energieniveau.
Sauerstoff ist das am häufigsten vorkommende Element dieser Gruppe und lebenswichtig, da es ein Schlüsselbestandteil von Wasser und vielen organischen Molekülen ist.
Elemente der Sauerstoffgruppe können mit vielen anderen Elementen, einschließlich Metallen und Nichtmetallen, Verbindungen eingehen.
Gruppe 17: Halogene
Die Gruppe 17 des Periodensystems wird auch als Halogengruppe bezeichnet. Es besteht aus sechs Elementen: Fluor, Chlor, Brom, Jod, Astatin und Tennessin.
Alle Halogene haben sieben Elektronen in ihrer äußersten Schale, auch Valenzschale genannt. Dadurch sind sie sehr reaktiv, da sie nur ein zusätzliches Elektron benötigen, um ihre äußere Hülle zu vervollständigen und stabil zu werden.
Ein weiteres wichtiges Merkmal von Halogenen ist, dass sie alle Nichtmetalle sind, was bedeutet, dass sie keinen Strom leiten und nicht wie Metalle formbar oder duktil sind.
Sie kommen auch bei Raumtemperatur in allen drei Aggregatzuständen vor, wobei Fluor und Chlor Gase, Brom eine Flüssigkeit und Jod und Astat Feststoffe sind.
Gruppe 18: Edelgase
Die Gruppe 18 des Periodensystems wird auch als Edelgase bezeichnet.
Zu den Edelgasen gehören Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) und Radon (Rn).
Diese Gase werden als Edelgase bezeichnet, da sie sehr stabil sind und nicht leicht mit anderen Elementen reagieren.
Edelgase befinden sich in der Spalte ganz rechts im Periodensystem und haben alle eine vollständige äußere Elektronenhülle, was sie sehr unreaktiv macht.
Sie sind außerdem geruchlos, farblos und haben niedrige Siede- und Schmelzpunkte.
