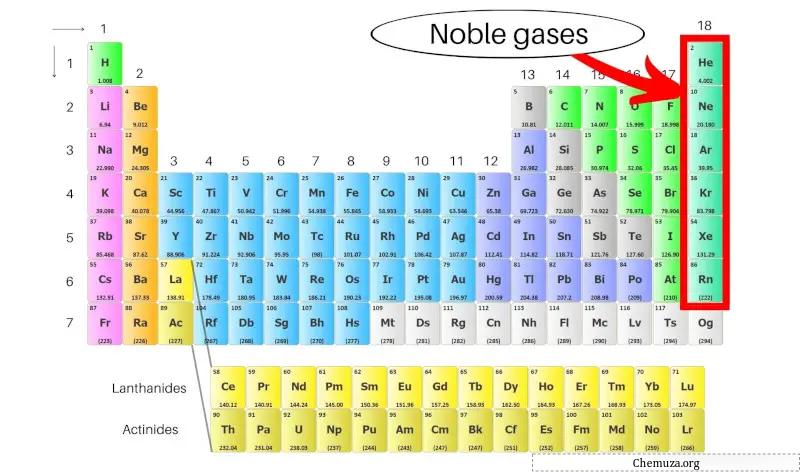
Edelgase, auch Edelgase genannt, sind eine Gruppe von Elementen, die sich in der Spalte ganz rechts im Periodensystem befinden. Dazu gehören Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) und Radon (Rn).
Diese Elemente sind aufgrund ihrer äußersten vollständigen Elektronenhülle für ihre geringe Reaktivität bekannt, wodurch sie stabil und unreaktiv mit anderen Elementen sind. [1]
Lassen Sie uns mehr über die Edelgase im Periodensystem erforschen.
Was sind Edelgase?
Edelgase sind Elemente der Gruppe 18 , die sich durch eine sehr geringe Reaktivität mit anderen Stoffen auszeichnen, was bedeutet, dass sie im Allgemeinen keine Verbindungen mit anderen Elementen eingehen.
Sie werden auch Inertgase genannt, weil sie sehr stabil sind und nicht leicht mit anderen Stoffen reagieren. Zu den Edelgasen zählen Helium, Neon, Argon, Krypton, Xenon und Radon.
Edelgase kommen in geringen Mengen in der Erdatmosphäre vor und werden in einer Vielzahl von Anwendungen verwendet, beispielsweise in der Beleuchtung, beim Schweißen und in der Kryotechnik. [2]
Warum sind Edelgase Edelgase?
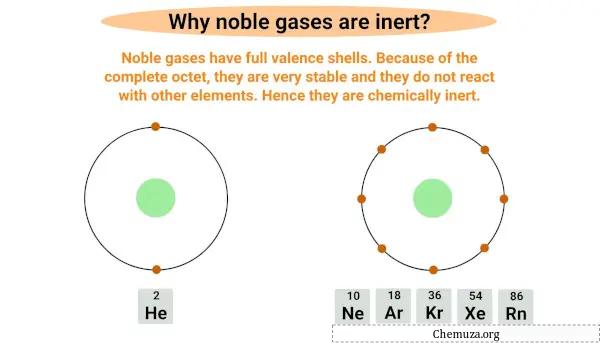
Edelgase sind inert bzw. nicht reaktiv, da sie eine vollständige äußerste Elektronenhülle, auch Valenzschale genannt, besitzen.
Die Valenzschale ist die äußerste Elektronenhülle, die ein Atom umgibt und dessen Valenzelektronen enthält, also die Elektronen, die an chemischen Reaktionen beteiligt sind.
Edelgase sind Volloktettgase , das heißt, sie haben eine vollständige Valenzschale mit acht Elektronen, mit Ausnahme von Helium, dessen äußerste Schale nur zwei Elektronen hat.
Ein volles Byte macht sie sehr stabil und es ist unwahrscheinlich, dass sie mit anderen Elementen reagieren.
Bei chemischen Reaktionen neigen Elemente dazu, Elektronen zu gewinnen oder zu verlieren, um ein vollständiges Oktett in ihrer Valenzschale zu erhalten. Da Edelgase jedoch bereits über eine vollständige Valenzschale verfügen, müssen sie keine Elektronen gewinnen oder verlieren.
Diese stabile Konfiguration von Edelgasen ist auf ihre elektronische Konfiguration zurückzuführen.
Die äußerste Elektronenhülle dieser Elemente ist voll und sie müssen daher keine Elektronen aufnehmen oder abgeben.
Das bedeutet, dass sie sehr reaktionsträge sind und nicht dazu neigen, chemische Bindungen mit anderen Elementen einzugehen.
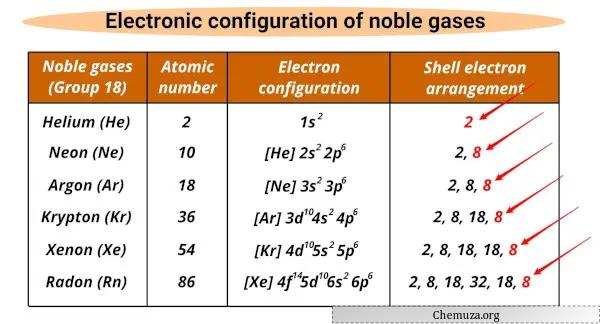
Liste der Edelgase und ihrer elektronischen Konfigurationen
Die Edelgase und ihre elektronischen Konfigurationen sind unten aufgeführt.
Was haben alle Edelgase gemeinsam?
Edelgase haben einige gemeinsame Eigenschaften .
Sie haben alle die gleiche Anzahl an Valenzelektronen (8), außer Helium, das 2 hat.
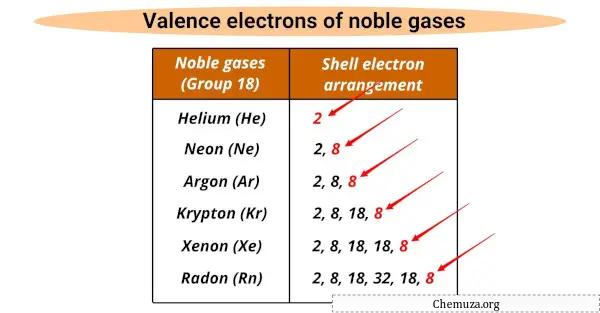
Valenzelektronen sind die äußersten Elektronen in einem Atom, die an chemischen Reaktionen teilnehmen, und Edelgase haben eine vollständige Valenzhülle , die sie nicht reaktiv macht.
Darüber hinaus sind Edelgase farblose Gase, die wir nicht sehen können, und sie sind auch geruchlos , das heißt, sie haben keinen Geruch. [3]
Schließlich kommen sie in der Natur als einatomige Gase vor, was bedeutet, dass sie in ihrer elementaren Form nur ein Atom haben.
Im Gegensatz zu den meisten anderen Elementen, die dazu neigen, durch Bindung an andere Atome Moleküle zu bilden, müssen Edelgase keine Bindungen an andere Atome eingehen, da sie über eine vollständige Valenzschale verfügen, was sie sehr stabil und nicht reaktiv macht.
Zusammenfassung
Edelgase sind eine Gruppe von Elementen, die in der Spalte ganz rechts im Periodensystem vorkommen, darunter Helium, Neon, Argon, Krypton, Xenon und Radon.
Sie zeichnen sich durch eine geringe Reaktivität aufgrund ihrer vollständig außenliegenden elektronischen Schichten aus. Edelgase sind inert oder nicht reaktiv, da sie eine vollvalente Hülle haben, was sie sehr stabil macht und es unwahrscheinlich macht, dass sie mit anderen Elementen reagieren.
Edelgase haben gemeinsame Eigenschaften, einschließlich der gleichen Anzahl an Valenzelektronen (8, außer Helium, das 2 hat), ein farb- und geruchloses Gas, und kommen in der Natur als einatomige Gase vor.
Sie werden in verschiedenen Anwendungen wie Beleuchtung, Schweißen und Kryotechnik sowie als Kühlmittel in Kernreaktoren und als Füllstoffe für Glühbirnen eingesetzt.
