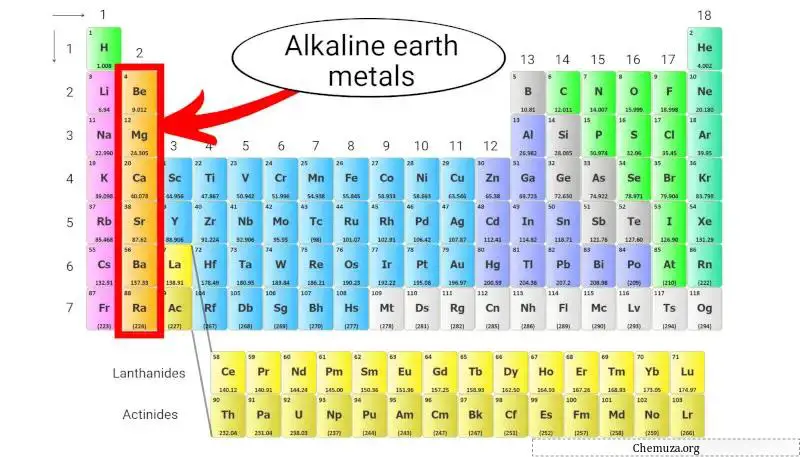
Erdalkalimetalle sind eine Gruppe von Elementen, die in der zweiten Spalte des Periodensystems stehen. Dazu gehören Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr), Barium (Ba) und Radium (Ra).
Diese Metalle haben zwei Elektronen in ihrer äußersten Schale, [1] was sie chemisch reaktiv macht, aber nicht so reaktiv wie die Alkalimetalle , die sich in der ersten Spalte befinden.
Lassen Sie uns mehr über die Erdalkalimetalle im Periodensystem erfahren.
Was sind Erdalkalimetalle?

Erdalkalimetalle gehören zur Gruppe 2 des Periodensystems und haben zwei besondere Eigenschaften.
- Wenn sie mit Wasser reagieren, bilden sie Hydroxide, die alkalischer oder basischer Natur sind.
- Ihre Oxidmineralien (BeO, Magnesit, MgO, Beryll etc.) kommen hauptsächlich in der Erdkruste vor und sind hitzestabil.
Erläuterung
Wenn Erdalkalimetalle (Mg, Ca, Sr, Ba und Ra) mit Wasser reagieren, bilden sie Hydroxide, die alkalischer (oder basischer) Natur sind. [2]
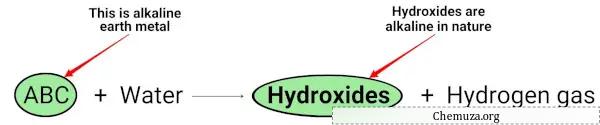
Sie können der obigen chemischen Gleichung entnehmen, dass Alkalimetalle Hydroxide ergeben, die basischer Natur sind (mit einem pH-Wert > 7) und Wasserstoffgas freisetzen.
Zum Beispiel:
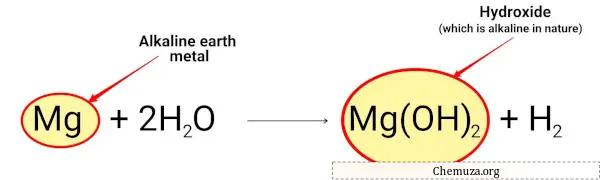
Magnesium reagiert mit Wasser und bildet Magnesiumhydroxid, das von Natur aus alkalisch ist.
Darüber hinaus kommen diese Metalle hauptsächlich in der Erdkruste vor (als Oxide) und diese oxidierten Mineralien sind hitzestabil. [2]
Diese beiden Kriterien geben diesen Metallen ihren Namen „Erdalkalimetalle“.
(Hinweis: Es ist wichtig zu beachten, dass Beryllium, das ebenfalls ein Element der Gruppe 2 ist, bei der Reaktion mit Wasser keine alkalische Lösung bildet. Stattdessen zeigen seine Hydroxide amphoteres Verhalten, was bedeutet, dass sie sich wie eine Säure oder eine Base verhalten können Daher gilt Beryllium nicht als Erdalkalimetall, obwohl es derselben Gruppe angehört.)
Was haben alle Erdalkalimetalle gemeinsam?
Erdalkalimetalle haben mehrere gemeinsame Eigenschaften.
Sie haben beispielsweise beide zwei Valenzelektronen in ihrem äußersten Energieniveau, was sie ziemlich reaktiv macht.
Diese Reaktivität ist auf die Tendenz zurückzuführen, diese Elektronen bei chemischen Reaktionen zu verlieren, was zur Bildung von Kationen mit einer Ladung von +2 führt.
Darüber hinaus haben alle Erdalkalimetalle ein glänzendes, silbrig-weißes Aussehen.

Das sind also die beiden wichtigsten Gemeinsamkeiten der Erdalkalimetalle.
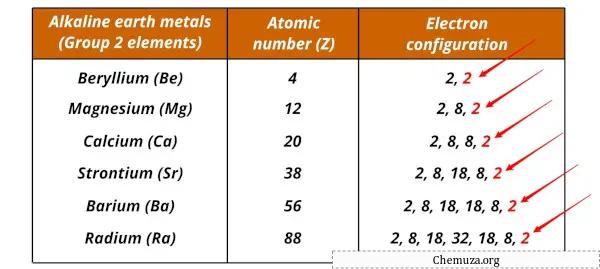
Liste der Alkalimetalle und ihrer elektronischen Konfigurationen
Nachfolgend sind Erdalkalimetalle und ihre elektronischen Konfigurationen aufgeführt.
| Element | Elektronische Konfiguration |
| Beryllium (Be) | [Er] 2s 2 |
| Magnesium (Mg) | [Do] 3s 2 |
| Kalzium (Ca) | [Ar] 4s 2 |
| Strontium (Sr) | [Kr] 5s 2 |
| Barium (Ba) | [Xe] 6s 2 |
| Radium (Ra) | [Rn] 7s 2 |
Periodische Trends bei Erdalkalimetallen
Wenn man sich in der Erdalkalimetallgruppe des Periodensystems nach unten bewegt, können die folgenden Trends beobachtet werden:
- Wertigkeit: Alle Erdalkalimetalle haben die gleiche Wertigkeit von +2. Es gibt also keine Änderung der Valenz, wenn wir in der Gruppe nach unten gehen.
- Atomgröße: Die Atomgröße der Erdalkalimetalle nimmt in der Gruppe nach unten zu. Dies liegt daran, dass die Anzahl der elektronischen Schichten (oder Umlaufbahnen ) zunimmt und die Abschirmwirkung der inneren Elektronen die Anziehungskraft zwischen dem Kern und den äußersten Elektronen verringert.
- Metallischer Charakter: Der metallische Charakter von Erdalkalimetallen nimmt zu, je weiter man in der Gruppe nach unten geht. Dies liegt daran, dass Atome größer werden und mehr Elektronen enthalten, wodurch sie leichter Elektronen verlieren und positive Ionen bilden können.
- Elektronegativität: Die Elektronegativität von Erdalkalimetallen nimmt mit zunehmender Stufe der Gruppe ab. Dies liegt daran, dass Atome größer werden und mehr Elektronenhüllen haben, wodurch es für sie schwieriger wird, Elektronen anzuziehen.
- Elektronische Affinität: Die elektronische Affinität von Erdalkalimetallen ist im Allgemeinen gering und nimmt ab, je weiter man in der Gruppe nach unten geht.
- Ionisierungsenergie: Die Ionisierungsenergie von Erdalkalimetallen nimmt mit zunehmender Stufe der Gruppe ab. Dies liegt daran, dass größere Atome mehr Elektronenhüllen haben und die äußersten Elektronen weiter vom Kern entfernt sind, wodurch sie leichter entfernt werden können.
Zusammenfassung
Zu den Erdalkalimetallen zählen Beryllium, Magnesium, Calcium, Strontium, Barium und Radium. Sie haben zwei Elektronen in ihrer äußersten Schale, was sie reaktiv macht, jedoch weniger reaktiv als Alkalimetalle.
Diese Metalle erzeugen bei Reaktion mit Wasser alkalische Hydroxide und enthalten hitzestabile oxidierte Mineralien. Die Hauptmerkmale aller Erdalkalimetalle sind, dass sie zwei Valenzelektronen haben, silberweiß und glänzend sind und Kationen mit einer Ladung von +2 bilden.
Die Wertigkeit bleibt die gleiche, wenn man in der Gruppe nach unten geht, aber die Atomgröße und der metallische Charakter nehmen zu, während Elektronegativität, Elektronenaffinität und Ionisierungsenergie abnehmen.
