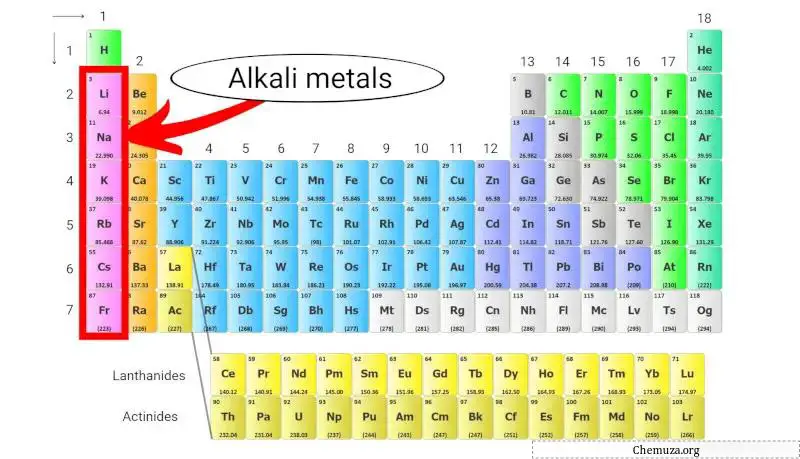
Alkalimetalle sind eine Gruppe chemischer Elemente, die in der ersten Spalte des Periodensystems stehen. Zu dieser Gruppe gehören Lithium , Natrium , Kalium , Rubidium , Cäsium und Francium .
Alkalimetalle sind weich und haben niedrige Schmelz- und Siedepunkte. Sie werden häufig in Batterien, Legierungen und verschiedenen chemischen Reaktionen verwendet.
Lassen Sie uns mehr über die Alkalimetalle im Periodensystem erfahren.
Was sind Alkalimetalle?

Alkalimetalle sind eine Gruppe chemischer Elemente im Periodensystem, die zur Gruppe 1 gehören.
Diese Elemente sind bekannt für ihre Weichheit, niedrige Schmelzpunkte, hohe Reaktivität und die Fähigkeit, bei Reaktion mit Wasser alkalische Lösungen zu bilden.
Zu den wichtigsten Eigenschaften von Alkalimetallen gehören:
- Sie haben niedrige Elektronegativitäten und Ionisierungsenergien, was bedeutet, dass sie dazu neigen, leicht Elektronen zu verlieren und Kationen zu bilden.
- Sie haben niedrige Schmelz- und Siedepunkte, wodurch sie relativ weich und leicht zu schmelzen sind.
- Sie haben eine hohe Reaktivität mit Wasser und Sauerstoff, wodurch sie in Luft und Wasser reaktiv sind.
- Sie sind gute Wärme- und Stromleiter.
Warum werden Alkalimetalle so genannt?

Alkalimetalle werden so genannt, weil sie bei der Reaktion mit Wasser stark alkalische (basische) Lösungen bilden können. [1]
Wenn diese Metalle mit Wasser in Kontakt kommen, setzen sie Wasserstoffgas frei und bilden Hydroxidionen, die der Lösung einen basischen pH-Wert verleihen.
Erläuterung:
Die Reaktivität von Alkalimetallen mit Wasser beruht auf ihrer geringen Ionisierungsenergie [2] , was bedeutet, dass sie leicht Elektronen verlieren und positive Ionen (Kationen) bilden können.
Bei Kontakt mit Wasser kommt es zu einer chemischen Reaktion, bei der sie Elektronen abgeben und mit Wassermolekülen unter Bildung von Hydroxidionen und Wasserstoffgas reagieren.
Bei dieser Reaktion wird viel Wärme freigesetzt, die dazu führen kann, dass sich das Wasserstoffgas entzündet und explodiert.
Reihenfolge der Reaktivität von Alkalimetallen
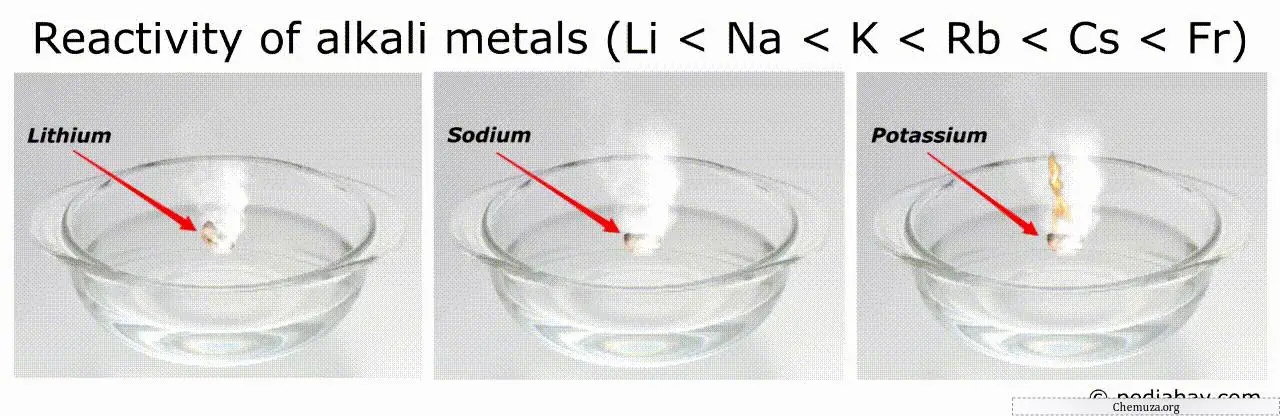
Der allgemeine Trend in der Reihenfolge der Reaktivität von Alkalimetallen besteht darin, dass sie zunimmt, wenn man in der Gruppe von Lithium (Li) nach Francium (Fr) vorrückt.
Dies bedeutet, dass Francium das reaktivste aller Alkalimetalle ist, während Lithium das am wenigsten reaktive ist.
Der Grund für diesen Trend liegt darin, dass mit zunehmender Abwärtsbewegung in der Gruppe der Atomradius der Elemente zunimmt, während die Ionisierungsenergie abnimmt.
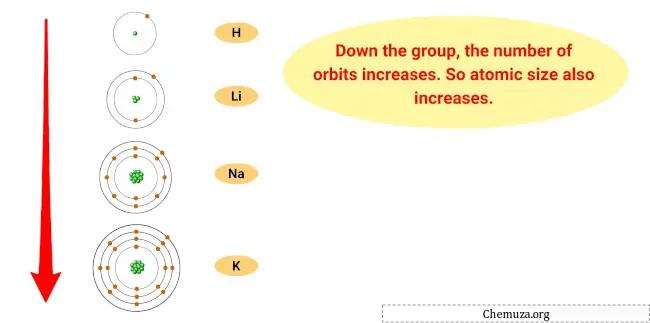
Dies bedeutet, dass das äußerste Elektron der Atome weiter vom Kern entfernt ist und weniger festgehalten wird, wodurch es für das Element leichter wird, dieses Elektron zu verlieren und zu einem Kation zu werden.
Francium ist das größte und am wenigsten verwandte Element der Gruppe und daher am reaktivsten.
Diese Reaktivitätsreihenfolge hat wichtige Auswirkungen auf die Eigenschaften und das Verhalten von Alkalimetallen.
Beispielsweise können sich die reaktivsten Metalle (wie Francium und Cäsium) in Luft oder Wasser spontan entzünden, was ihre Handhabung sehr gefährlich macht.[3]
Umgekehrt sind weniger reaktive Metalle (wie Lithium) stabiler und können in Anwendungen verwendet werden, die ein stabileres Metall erfordern.
Liste der Alkalimetalle und ihrer elektronischen Konfigurationen
Nachfolgend sind Alkalimetalle und ihre elektronischen Konfigurationen aufgeführt.
| Element | Elektronische Konfiguration |
| Lithium (Li) | [Es] 2s 1 |
| Natrium (Na) | [Do] 3s 1 |
| Kalium (K) | [Ar] 4s 1 |
| Rubidium (Rb) | [Kr] 5s 1 |
| Cäsium (Cs) | [Xe] 6s 1 |
| Francium (Fr) | [Rn] 7s 1 |
Periodische Trends bei Alkalimetallen
Nachfolgend sind die periodischen Trends der Alkalimetalle aufgeführt:
- Wertigkeitstrend: Die Wertigkeit von Alkalimetallen beträgt immer +1, was bedeutet, dass sie dazu neigen, ein Elektron zu verlieren, um ein stabiles Kation zu bilden. Es gibt daher keine Änderung der Wertigkeit der Alkalimetalle, wenn man in der Gruppe nach unten geht. Sie haben alle die gleiche Wertigkeit (dh 1).
- Trend zur Atomgröße: Die Atomgröße von Alkalimetallen nimmt mit zunehmender Gruppengröße zu, was bedeutet, dass die Atome größer werden. Dies liegt daran, dass die Größe der Elektronenwolke zunimmt, wenn man Energieniveaus hinzufügt.
- Trend zum metallischen Charakter: Der metallische Charakter von Alkalimetallen nimmt in der Gruppe nach unten zu. Dies liegt daran, dass Metalle elektropositiver werden und besser in der Lage sind, Elektronen abzugeben, um metallische Bindungen zu bilden.
- Elektronegativitätstrend: Die Elektronegativität von Alkalimetallen nimmt mit zunehmender Gruppe ab. Dies liegt daran, dass die Atome größer werden und die äußeren Elektronen weiter vom Kern entfernt sind, sodass sie weniger von ihm angezogen werden.
- Elektronenaffinitätstrend: Die Elektronenaffinität von Alkalimetallen nimmt mit zunehmender Gruppe ab. Tatsächlich nimmt am unteren Ende der Gruppe die Größe der Atome zu, was die Tendenz eines Atoms, das Elektron aufzunehmen, verringert. (Lesen Sie hier mehr über den Elektronenaffinitätstrend, um ein detailliertes Verständnis zu erhalten.)
- Trend zur Ionisierungsenergie: Die Ionisierungsenergie von Alkalimetallen nimmt mit zunehmender Stufe der Gruppe ab. Dies bedeutet, dass es einfacher ist, ein Elektron aus der äußersten Hülle des Atoms zu entfernen, da die Elektronen weiter vom Kern entfernt sind und weniger festgehalten werden.
Zusammenfassung
Alkalimetalle sind eine Gruppe chemischer Elemente, die für ihre Weichheit, ihren niedrigen Schmelzpunkt, ihre hohe Reaktivität und ihre Fähigkeit bekannt sind, bei Reaktion mit Wasser alkalische Lösungen zu bilden.
Die Reaktivitätsreihenfolge der Alkalimetalle nimmt aufgrund des zunehmenden Atomradius und der abnehmenden Ionisierungsenergie zu, je weiter man in der Gruppe von Lithium zu Francium vorrückt.
Zu den periodischen Trends bei den Alkalimetallen gehören eine Zunahme der Atomgröße und des metallischen Charakters, je weiter man in der Gruppe voranschreitet, sowie eine Abnahme der Elektronegativität, Elektronenaffinität und Ionisierungsenergie.
Die Wertigkeit von Alkalimetallen beträgt immer +1 und ihre elektronischen Konfigurationen folgen einem [Edelgas]-ns- 1- Modell.
