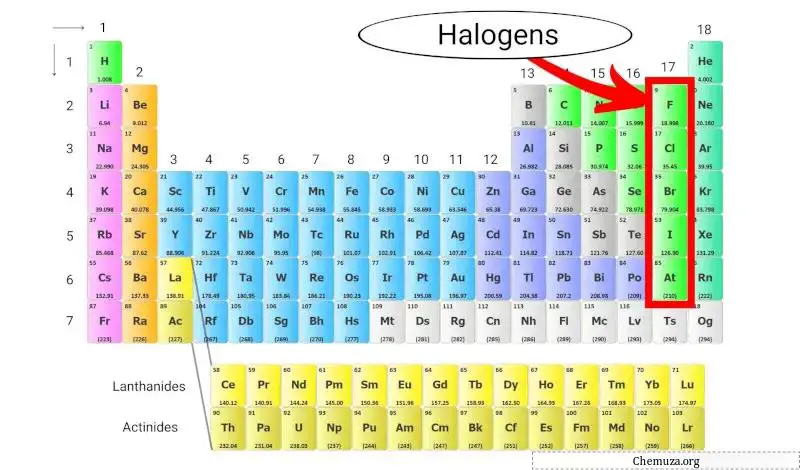
Halogene sind eine Gruppe von Elementen, die in Gruppe 17 (auch Halogengruppe genannt) des Periodensystems vorkommen. Zu den Halogenen gehören fünf verschiedene Elemente: Fluor (F), Chlor (Cl), Brom (Br), Jod (I) und Astat (At).
Halogene sind einzigartig, weil sie die einzige Elementgruppe sind, die mit allen anderen Elementen des Periodensystems Verbindungen eingehen kann.
Lassen Sie uns Halogene weiter erforschen.
Was sind Halogene? Und warum heißen sie so?
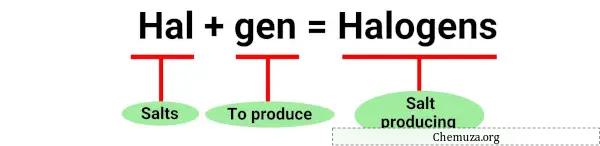
Der Begriff „Halogen“ leitet sich von den griechischen Wörtern „halos“ für Salz und „genes“ für Produzent ab. [1]
Tatsächlich wurden Halogene erstmals durch ihre Fähigkeit entdeckt, bei der Reaktion mit Metallen Salze zu bilden.
Zum Beispiel:
Wenn Chlor (Cl 2 ) mit Natrium (Na) reagiert, entsteht Natriumchlorid (NaCl), ein gewöhnliches Speisesalz:
2Na + Cl2 → 2NaCl
Wenn Brom (Br 2 ) mit Kalium (K) reagiert, bildet es Kaliumbromid (KBr):
2K + Br2 → 2KBr
Diese Reaktionen sind Beispiele für die Bildung von Salzen durch Halogene, wenn sie mit Metallen reagieren, daher der Name „Halogen“.
Das reaktivste Halogen im Periodensystem
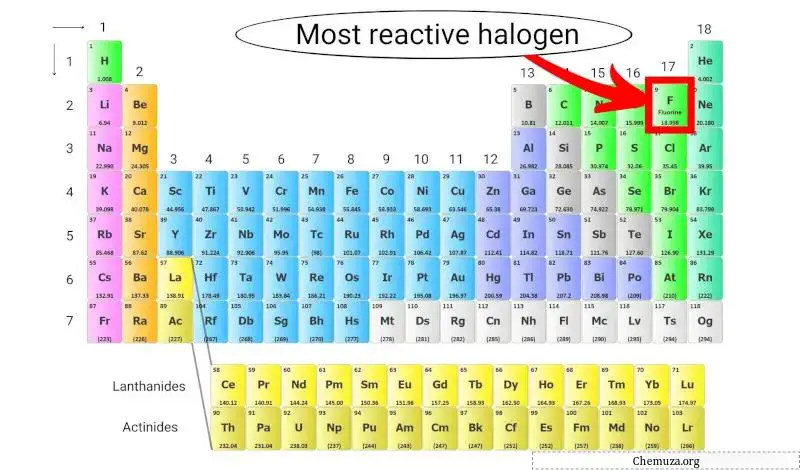
Fluor ist das reaktivste Halogen, da es die höchste Elektronegativität aller Elemente im Periodensystem aufweist und daher eine starke Anziehungskraft auf Elektronen ausübt.
Dadurch ist es sehr reaktiv und in der Lage, mit fast jedem anderen Element im Periodensystem zu reagieren und Verbindungen zu bilden. [2]
Einfach ausgedrückt ist Fluor wie ein Magnet für Elektronen und wird alles tun, um ein Elektron zu gewinnen und seine äußere Hülle zu vervollständigen.
Dies geschieht, indem es mit anderen Elementen reagiert und deren Elektronen stiehlt, um neue Verbindungen zu bilden.
Deshalb ist Fluor so reaktiv und kommt in der Natur nie in elementarer Form vor, sondern immer als Verbindung.
Aufgrund seiner hohen Reaktivität ist Fluorid außerdem äußerst gefährlich und kann unsicher in der Anwendung sein.
Es wird häufig in Speziallabors gehandhabt und in industriellen Prozessen zur Herstellung einer Vielzahl von Chemikalien und Materialien verwendet.
Reaktivität von Halogenen
Halogene sind aufgrund ihrer höheren Elektronegativität sehr reaktiv, was bedeutet, dass sie eine sehr hohe Fähigkeit haben, Elektronen anzuziehen.
Darüber hinaus haben Halogene 7 Elektronen in ihrer äußersten Schale und benötigen nur ein zusätzliches Elektron, um diese zu füllen und eine stabile elektronische Konfiguration wie Edelgase zu erreichen.
Sie können beispielsweise sehen, dass das Bohr-Diagramm für Fluor 7 Elektronen in seiner äußersten Schale hat.
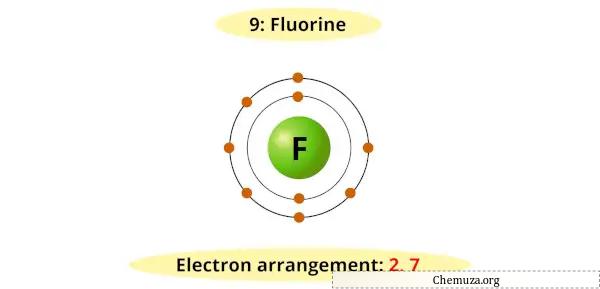
Es braucht nun 1 zusätzliches Elektron, um ein stabiles Oktett zu erhalten (7 + 1 = 8).
Halogene reagieren mit Metallen und bilden ionische Verbindungen, sogenannte Metallhalogenide , die helle, farbenfrohe Flammen erzeugen können.
Sie reagieren auch mit Nichtmetallen wie Wasserstoff , Schwefel und Stickstoff und bilden eine Reihe kovalenter Verbindungen. [3]
Daher sind Halogene aufgrund ihrer Tendenz, ein Elektron aufzunehmen und eine stabile Edelgaskonfiguration zu erhalten, sehr reaktiv und in der Lage, Verbindungen mit anderen Elementen einzugehen.
Periodische Halogentrends
Wenn wir uns in der Gruppe nach unten bewegen, zeigen die Halogenelemente Veränderungen in ihren physikalischen und chemischen Eigenschaften.
Schauen wir uns die Trends bei einigen Eigenschaften von Halogenen an.
- Atomgröße: Je tiefer wir in der Gruppe vorgehen, desto größer wird die Atomgröße der Halogene. Dies liegt daran, dass jedes Halogen ein Energieniveau mehr hat als das darüber liegende, was bedeutet, dass die äußersten Elektronen weiter vom Kern entfernt sind.
- Elektronegativität: Wenn man in der Gruppe nach unten geht, nimmt die Elektronegativität der Halogenelemente ab. Dies bedeutet, dass Halogene an der Spitze der Gruppe, wie Fluor und Chlor, elektronegativer sind und daher eher Elektronen anziehen als Halogene an der Unterseite, wie Jod und Astat.
- Schmelz- und Siedepunkte: Je weiter man sich in der Gruppe nach unten bewegt, desto höher werden die Schmelz- und Siedepunkte der Halogene. Tatsächlich haben größere Atome mehr Elektronen und sind in der Lage, stärkere intermolekulare Kräfte auszubilden. [4]
- Reaktivität gegenüber Metallen: Je weiter man in der Gruppe nach unten geht, desto geringer ist die Reaktivität von Halogenen gegenüber Metallen. Dies bedeutet, dass Halogene an der Spitze der Gruppe, wie Fluor und Chlor, eher mit Metallen reagieren als Halogene an der Spitze der Gruppe, wie Jod und Astat.
Zusammenfassung
Halogene sind eine Gruppe von fünf Elementen (Fluor, Chlor, Brom, Jod und Astat), die in Gruppe 17 des Periodensystems vorkommen. Sie zeichnen sich durch ihre einzigartige Fähigkeit aus, mit allen anderen Elementen Verbindungen einzugehen.
Halogene sind aufgrund ihrer hohen Elektronegativität und der Tendenz, ein Elektron aufzunehmen, um eine stabile Edelgaskonfiguration zu erreichen, sehr reaktiv. Fluor ist aufgrund seiner hohen Elektronegativität das reaktivste Halogen.
Wenn man in der Gruppe nach unten geht, zeigen Halogene Veränderungen in ihren physikalischen und chemischen Eigenschaften, wie z. B. eine Zunahme der Atomgröße, eine Abnahme der Elektronegativität und einen Anstieg der Schmelz- und Siedepunkte. Die Reaktivität von Halogenen gegenüber Metallen nimmt ebenfalls ab, wenn man in der Gruppe nach unten geht.
