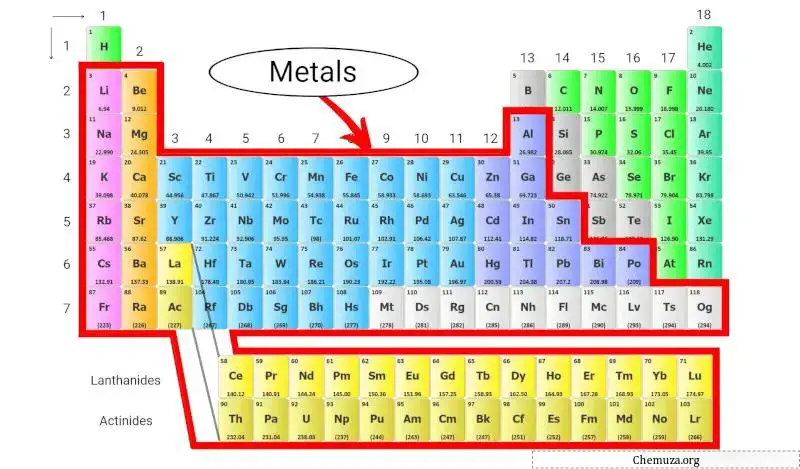
Die Metalle des Periodensystems sind wichtige Elemente, die wir überall um uns herum finden, von den Münzen in unseren Taschen bis zu den Drähten, die unsere Häuser mit Strom versorgen. Tatsächlich sind die meisten Elemente im Periodensystem Metalle!
Sie haben einige gemeinsame Eigenschaften, wie zum Beispiel, dass sie glänzend sind, Wärme und Strom gut leiten und formbar sind (das heißt, sie können gebogen oder geformt werden, ohne zu brechen). [1]
Lassen Sie uns mehr über Metalle und die verschiedenen Arten von Metallen im Periodensystem erfahren.
Was genau sind Metalle?
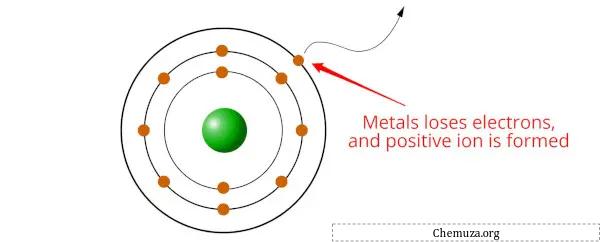
Metalle sind Elemente, die bei chemischen Reaktionen dazu neigen, Elektronen zu verlieren und Kationen (positiv geladene Ionen) zu bilden.
Aber wissen Sie, warum das passiert?
Dies liegt daran, dass Metalle eine niedrige Ionisierungsenergie haben, was bedeutet, dass relativ wenig Energie benötigt wird, um ein Elektron aus einem Metallatom zu entfernen. Wenn ein Metallatom ein oder mehrere Elektronen verliert, wird es zu einem positiv geladenen Kation .
Metalle neigen dazu, Elektronen zu verlieren, um eine stabilere elektronische Konfiguration zu erhalten, normalerweise durch den Erhalt eines stabilen Oktetts (dh 8 Elektronen in der äußersten Schale).
Schauen wir uns nun die verschiedenen Arten von Metallen an, die im Periodensystem klassifiziert sind.
Alkali Metalle
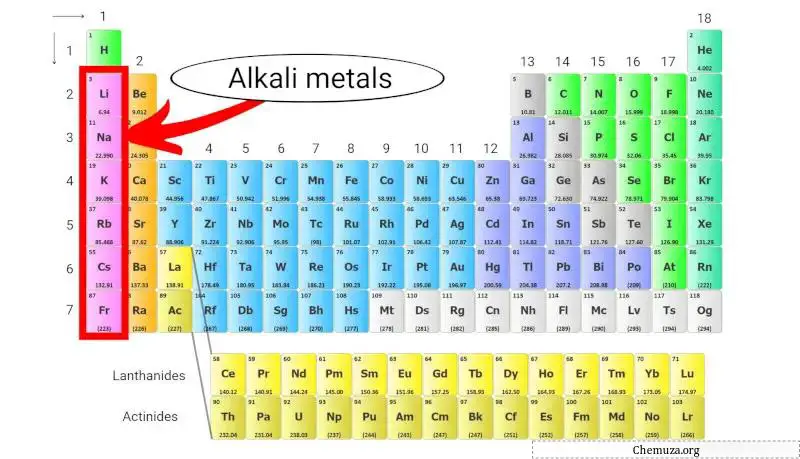
Alkalimetalle sind eine Gruppe von Elementen im Periodensystem, bestehend aus Lithium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Cäsium (Cs) und Francium (Fr).
Sie gehören zur Gruppe 1 des Periodensystems, auch bekannt als „Alkalimetallgruppe“.
Alkalimetalle sind aufgrund ihrer niedrigen Ionisierungsenergien sehr reaktiv, was die Wahrscheinlichkeit erhöht, dass sie ihr einzelnes Valenzelektron verlieren und ein Kation mit einer Ladung von +1 bilden. [2]
Erfahren Sie mehr über: Alkalimetalle des Periodensystems .
Erdalkalimetalle
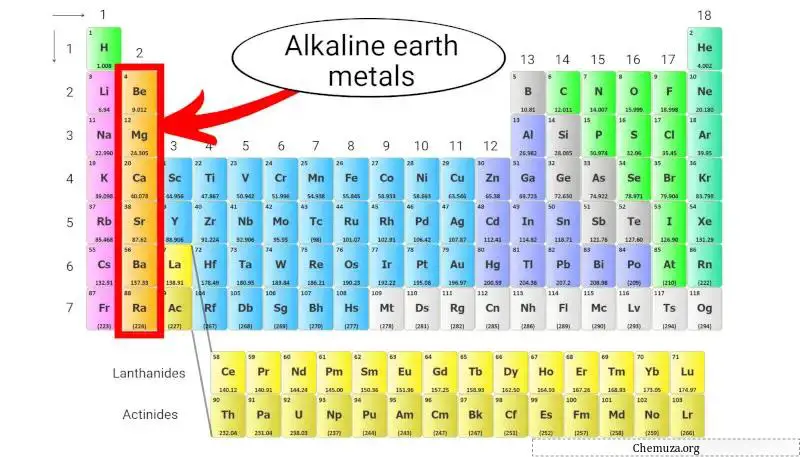
Erdalkalimetalle sind eine Gruppe von Elementen im Periodensystem, bestehend aus Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr), Barium (Ba) und Radium (Ra).
Sie gehören zur Gruppe 2 des Periodensystems, auch bekannt als „Erdalkalimetallgruppe“.
Erdalkalimetalle sind weniger reaktiv als Alkalimetalle, haben jedoch dennoch relativ niedrige Ionisierungsenergien und neigen dazu, Kationen mit einer Ladung von +2 zu bilden. [3]
Erfahren Sie mehr über: Erdalkalimetalle des Periodensystems .
Übergangsmetalle
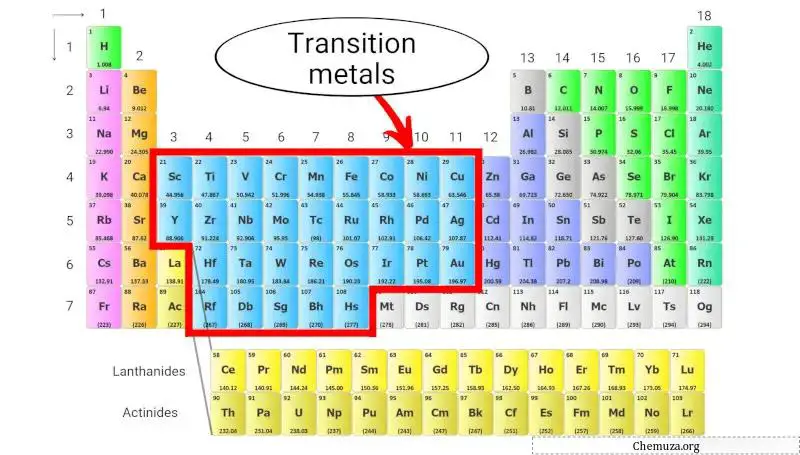
Übergangsmetalle sind eine Gruppe metallischer Elemente, die sich in der Mitte des Periodensystems befinden und die Gruppen 3 bis 11 besetzen (siehe Abbildung oben).
Sie zeichnen sich durch ihre Fähigkeit zur Bildung farbiger Verbindungen, ihre vielfältigen Oxidationsstufen sowie ihre relativ hohen Dichten und Schmelzpunkte aus.
Übergangsmetalle sind für ihre chemische Reaktivität bekannt und werden oft als Katalysatoren in chemischen Reaktionen eingesetzt. Sie werden auch in verschiedenen Anwendungen eingesetzt, beispielsweise bei der Herstellung von Stahl und anderen Legierungen, Elektronik und Batterien.
Erfahren Sie mehr über: Übergangsmetalle des Periodensystems .
Interne Übergangsmetalle
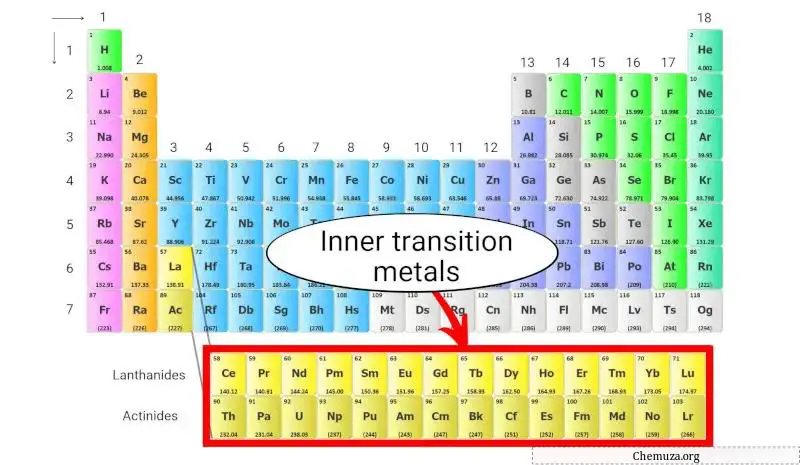
Die inneren Übergangsmetalle sind eine Gruppe metallischer Elemente, die sich am Ende des Periodensystems unterhalb des Hauptteils des Periodensystems befinden.
Sie sind in zwei Untergruppen unterteilt:
- Lanthanide und
- Aktiniden.
Die elektronische Konfiguration interner Übergangsmetalle ist einzigartig, da Elektronen die f-Orbitale ihrer Atome füllen. Dies führt zu besonderen elektronischen und magnetischen Eigenschaften, die sie für verschiedene technologische Anwendungen sehr nützlich machen.
Erfahren Sie mehr über: Interne Übergangsmetalle des Periodensystems .
Seltenerdmetalle
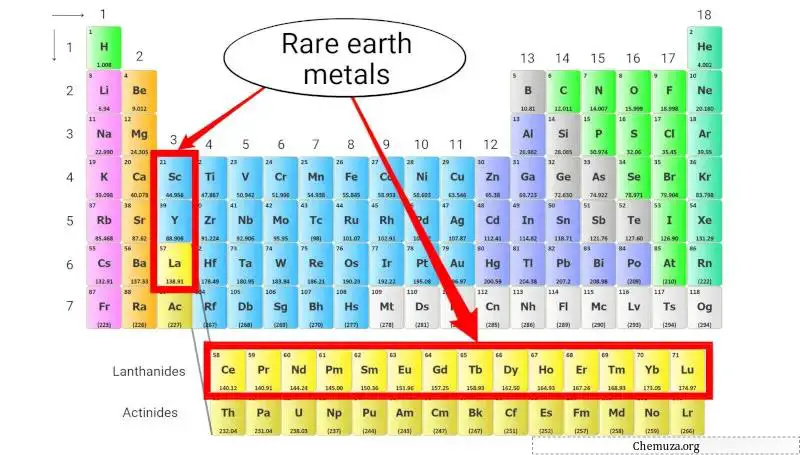
Seltenerdmetalle, auch Seltenerdelemente genannt, sind eine Gruppe metallischer Elemente, zu denen die Lanthanoidreihe (Ordnungszahlen 57 bis 71), Scandium (Sc) und Yttrium (Y) gehören.
Trotz ihres Namens sind Seltenerdmetalle nicht wirklich selten, ihre Gewinnung aus Erzen ist jedoch aufgrund ihrer geringen Konzentration und chemischen Ähnlichkeit schwierig und teuer. [4]
Schwermetalle
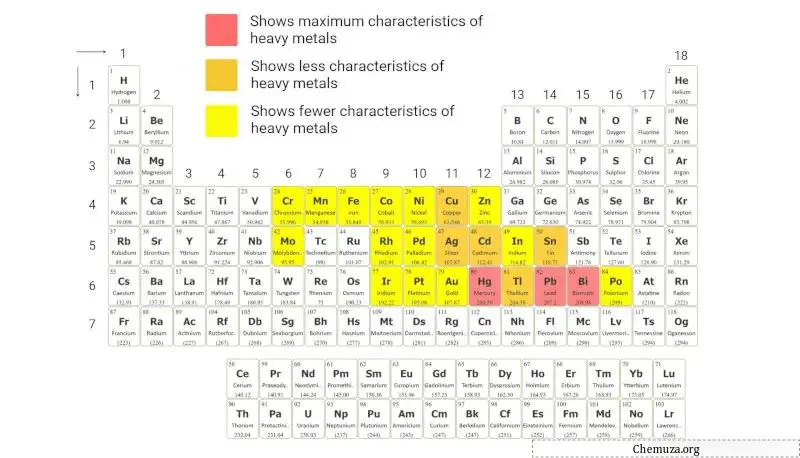
Schwermetalle sind eine Gruppe metallischer Elemente mit relativ hoher Atommasse und Dichte.
Schwermetalle werden üblicherweise anhand ihrer hohen Dichte identifiziert, die im Allgemeinen mehr als 5 g/cm³ beträgt .
Das obige Periodensystem bietet eine visuelle Darstellung dieser Elemente basierend auf dieser Klassifizierung.
Erfahren Sie mehr über: Schwermetalle im Periodensystem .
Zusammenfassung
Metalle sind Elemente, die bei chemischen Reaktionen dazu neigen, Elektronen zu verlieren und Kationen zu bilden. Sie haben niedrige Ionisierungsenergien, was die Wahrscheinlichkeit erhöht, dass sie Elektronen verlieren und zu positiv geladenen Ionen werden.
Das Periodensystem enthält verschiedene Arten von Metallen, darunter Alkalimetalle, Erdalkalimetalle, Übergangsmetalle, interne Übergangsmetalle, Seltenerdmetalle und Schwermetalle.
Alkalimetalle sind sehr reaktiv, während Erdalkalimetalle weniger reaktiv sind. Übergangsmetalle sind für ihre Fähigkeit bekannt, bunte Verbindungen und mehrere Oxidationsstufen zu bilden, und interne Übergangsmetalle besitzen einzigartige elektronische und magnetische Eigenschaften. Seltenerdmetalle sind schwierig und teuer zu gewinnen, während Schwermetalle eine hohe Dichte aufweisen.
