Nickelsulfid (NiS) ist eine Verbindung aus Nickel und Schwefel. Aufgrund seiner einzigartigen Eigenschaften und Anwendungen wird es in verschiedenen Branchen eingesetzt, darunter in der Keramik- und Glasindustrie.
| IUPAC-Name | Nickelsulfid |
| Molekularformel | NiS |
| CAS-Nummer | 16812-54-7 |
| Synonyme | Nickel(II)-sulfid, Nickelmonosulfid, Nickelsulfid |
| InChI | InChI=1S/Ni.S/q+2;-2 |
Eigenschaften von Nickelsulfid
Nickelsulfid-Formel
Die chemische Formel für Nickelmonosulfid lautet NiS. Es besteht aus einem Nickelatom (Ni) und einem Schwefelatom (S), was auf ein Verhältnis von eins zu eins zwischen den beiden Elementen hinweist.
Molmasse von Nickelsulfid
Die Molmasse von Nickelmonosulfid (NiS) beträgt etwa 90,76 Gramm pro Mol (g/mol). Dieser Wert wird durch Addition der Atommassen eines Nickelatoms und eines Schwefelatoms berechnet.
Siedepunkt von Nickelsulfid
Nickelsulfid hat keinen genau definierten Siedepunkt, da es aufgrund seiner chemischen Eigenschaften dazu neigt, sich vor Erreichen seines Siedepunkts zu zersetzen. Allerdings kann diese Zersetzung bei hohen Temperaturen auftreten.
Schmelzpunkt von Nickelsulfid
Der Schmelzpunkt von Nickelmonosulfid liegt bei etwa 797 Grad Celsius (1.467 Grad Fahrenheit). Diese Temperatur stellt den Punkt dar, an dem festes Nickelmonosulfid in den flüssigen Zustand übergeht.
Dichte von Nickelsulfid g/ml
Die Dichte von Nickelmonosulfid beträgt etwa 5,9 Gramm pro Kubikzentimeter (g/cm³). Dieser Dichtewert gibt die Masse des Nickelmonosulfids pro Volumeneinheit an und ist aufgrund der kompakten Anordnung seiner Atome relativ hoch.
Molekulargewicht von Nickelsulfid
Das Molekulargewicht von Nickelmonosulfid (NiS) beträgt etwa 90,76 g/mol. Dieser Wert wird durch Addition der in der Verbindung vorhandenen Atomgewichte von Nickel und Schwefel ermittelt.
Struktur von Nickelsulfid
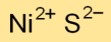
Nickelmonosulfid kann verschiedene Kristallstrukturen annehmen, einschließlich hexagonaler und kubischer Anordnungen. Diese Strukturen beeinflussen seine physikalischen und chemischen Eigenschaften und machen es für verschiedene Anwendungen wie Halbleiter und Katalysatoren nützlich.
Löslichkeit von Nickelsulfid
Nickelmonosulfid ist in Wasser und vielen anderen Lösungsmitteln nur begrenzt löslich. Seine Löslichkeit hängt von Faktoren wie Temperatur, pH-Wert und der Anwesenheit anderer Ionen ab. Im Allgemeinen gilt es als in wässrigen Lösungen unlöslich. Es kann jedoch mit Säuren reagieren und lösliche Nickelsalze bilden.
| Aussehen | Tiefes Schwarz |
| Spezifisches Gewicht | 5,9 g/cm³ |
| Farbe | Schwarz |
| Geruch | Geruchlos |
| Molmasse | 90,76 g/Mol |
| Dichte | 5,9 g/cm³ |
| Fusionspunkt | 797 °C (1467 °F) |
| Siedepunkt | Zersetzt sich bei hohen Temperaturen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Begrenzte Löslichkeit |
| Löslichkeit | Unlöslich in Wasser, reagiert mit Säuren unter Bildung löslicher Nickelsalze |
| Dampfdruck | Unzutreffend |
| Wasserdampfdichte | Unzutreffend |
| pKa | Unzutreffend |
| pH-Wert | Neutral |
Sicherheit und Gefahren von Nickelsulfid
Nickelmonosulfid birgt potenzielle Sicherheitsrisiken. Das Einatmen oder Verschlucken des Staubs kann zu Reizungen der Atemwege und Verdauungsbeschwerden führen. Hautkontakt kann insbesondere bei empfindlichen Personen zu Reizungen oder Dermatitis führen. Eine längere Exposition gegenüber hohen Konzentrationen kann zu ernsteren Atemwegsproblemen führen. Bei der Verbrennung oder Zersetzung werden giftige Dämpfe freigesetzt, die eine ausreichende Belüftung und Schutzausrüstung erfordern. Zur sicheren Handhabung sind Handschuhe, Schutzbrille und Laborkittel erforderlich. Kontakt mit Augen, Haut und Kleidung vermeiden. Bei Exposition die betroffenen Stellen mit Wasser spülen und bei anhaltenden Symptomen einen Arzt aufsuchen. Befolgen Sie immer die Sicherheitsanweisungen und arbeiten Sie in gut belüfteten Bereichen.
| Gefahrensymbole | Reizend, Gesundheitsgefährlich |
| Sicherheitsbeschreibung | Mit Vorsicht behandeln. Verwenden Sie geeignete Schutzausrüstung. Vermeiden Sie Haut- und Augenkontakt sowie das Einatmen von Staub. Arbeiten Sie in gut belüfteten Bereichen. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | Unzutreffend |
| Gefahrenklasse | Umweltrisiko (N) |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Kann Reizungen verursachen; Eine längere Exposition gegenüber hohen Konzentrationen kann zu schwerwiegenderen Atemwegsproblemen führen. |
Methoden zur Nickelsulfid-Synthese
Nickelmonosulfid kann auf verschiedene Weise synthetisiert werden. Ein üblicher Ansatz beinhaltet die Reaktion zwischen einem löslichen Ni-Salz wie NiCl2 oder Ni(NO3)2 und einer löslichen Sulfidquelle wie Natriumsulfid oder Schwefelwasserstoffgas. Bei dieser Fällungsmethode entsteht als Produkt festes Nickelmonosulfid.
Eine weitere Methode ist die thermische Zersetzung von Nickelverbindungen in Gegenwart von Schwefelquellen. Beispielsweise kann durch Erhitzen von Nickelsalzen wie Nickelcarbonat oder Nickelhydroxid mit Schwefel bei hohen Temperaturen Nickelmonosulfid entstehen.
Die chemische Gasphasenabscheidung (CVD) wird zur Abscheidung dünner Nickelmonosulfidfilme verwendet. Bei dieser Methode werden gasförmige Nickel- und Schwefelvorläufer in eine kontrollierte Umgebung eingeführt, wo sie reagieren und eine dünne Schicht Nickelmonosulfid auf einem Substrat bilden.
Bei der hydrothermalen Synthese werden wässrige Lösungen von Nickelsalzen und Schwefelverbindungen bei hoher Temperatur und hohem Druck umgesetzt. Diese Methode ermöglicht die kontrollierte Bildung von Nickelmonosulfid-Nanopartikeln.
Insgesamt bieten diese Methoden vielfältige Möglichkeiten zur Synthese von Nickelmonosulfid und erfüllen unterschiedliche Anwendungen und Anforderungen in Branchen wie Elektronik, Katalyse und Materialwissenschaften.
Verwendung von Nickelsulfid
Aufgrund seiner einzigartigen Eigenschaften findet Nickelmonosulfid branchenübergreifend vielseitige Anwendung. Zu den wichtigsten Einsatzmöglichkeiten gehören:
- Katalysatoren: Es dient als Katalysator bei verschiedenen chemischen Reaktionen, einschließlich Hydrierungs- und Entschwefelungsprozessen in der Erdölindustrie.
- Halbleiter: Hersteller verwenden Nickelmonosulfid zur Herstellung von Halbleitern, insbesondere in Dünnschichtsolarzellen, wo es als wesentlicher Bestandteil der Absorberschicht dient.
- Glas und Keramik: Nickelmonosulfid verbessert sowohl die Farbe als auch die Opazität von Glas und Keramik und spielt eine entscheidende Rolle bei der Herstellung dekorativer und funktionaler Objekte.
- Thermoelektrische Materialien: Forscher untersuchen Nickelmonosulfid auf seine thermoelektrischen Eigenschaften mit dem Ziel, seine Fähigkeit zu nutzen, Wärmeunterschiede in thermoelektrischen Geräten in elektrische Energie umzuwandeln.
- Elektroden: Wiederaufladbare Batterien profitieren von Nickelmonosulfid, da es aufgrund seiner außergewöhnlichen elektrischen Leitfähigkeit und Stabilität als Elektrodenmaterial fungiert.
- Gassensoren: Nickelmonosulfid-Materialien spielen eine Schlüsselrolle in Gassensoren und ermöglichen die Erkennung von Gasen wie Wasserstoff, Ammoniak und Schwefeldioxid.
- Medizin: In verschiedenen medizinischen Anwendungen wird nanoskaliges Nickelmonosulfid für Arzneimittelabgabesysteme und die Krebsbehandlung eingesetzt.
- Geschwefeltes Glas: Es trägt zur Bildung von geschwefeltem Glas mit einzigartigen optischen Eigenschaften bei, das für Infrarotoptiken geeignet ist.
- Brennstoffzellen: Nickelmonosulfid-Nanopartikel werden aufgrund ihrer elektrokatalytischen Eigenschaften auf mögliche Anwendungen in Brennstoffzellen untersucht.
- Korrosionsbeständigkeit: Wenn es Metallen zugesetzt wird, verbessert es deren Korrosionsbeständigkeitseigenschaften.
Die Anpassungsfähigkeit von Nickelmonosulfid an verschiedene Sektoren zeigt, dass es zu Fortschritten in den Bereichen Materialien, Elektronik, Energie und darüber hinaus beiträgt.
Fragen:
F: Wie lautet die Formel für Nickel(ii)-sulfid?
A: Die Formel für Nickel(II)monosulfid lautet NiS.
F: Ist Nickelsulfid löslich?
A: Nickelmonosulfid ist im Allgemeinen in Wasser unlöslich.
F: Ist Nickel-II-Sulfid wasserlöslich?
A: Nein, Nickel(II)monosulfid ist in Wasser unlöslich.
F: Ist Nickel(ii)-sulfid löslich oder unlöslich?
A: Nickel(II)monosulfid ist in Wasser unlöslich.
F: Kommt es zu einer Reaktion, wenn wässrige Lösungen von Nickel(ii)-chlorid und Natriumsulfid kombiniert werden?
A: Ja, es findet eine Reaktion statt, bei der Nickel(II)-monosulfid als fester Niederschlag entsteht.
F: Wie hoch ist die molare Löslichkeit von Nickel(ii)-sulfid in 0,053 m kcn?
A: Die molare Löslichkeit von Nickel(II)-monosulfid in 0,053 M KCN wird auf der Grundlage spezifischer Gleichgewichtskonstanten berechnet.
F: Was ist das Ergebnis einer Reaktion zwischen Nickel(iii)-nitrat und Rubidiumsulfid?
A: Eine Reaktion zwischen Nickel(III)-nitrat und Rubidiumsulfid führt zur Bildung von Produkten, die durch ihre jeweiligen chemischen Eigenschaften bestimmt werden.
F: Wie schreibt man eine Formel, wenn Nickel(ii)-sulfid gefunden wird?
A: Die Formel für Nickel(II)monosulfid lautet NiS.
