Nickelcarbonat (NiCO3) entsteht aus Nickelionen und Carbonationen. Aufgrund seiner einzigartigen Eigenschaften ist es ein grüner Feststoff, der in Keramik und Katalysatoren verwendet wird.
| IUPAC-Name | Nickel(II)carbonat |
| Molekularformel | NiCO3 |
| CAS-Nummer | 3333-67-3 |
| Synonyme | Nickelcarbonat; Kohlensäure, Nickelsalz, Nickelmonocarbonat |
| InChI | InChI=1S/CH2O3.Ni/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
Eigenschaften von Nickelcarbonat
Nickelcarbonat-Formel
Die chemische Formel für Nickelmonocarbonat lautet NiCO3. Es besteht aus einem Nickelatom (Ni), einem Kohlenstoffatom (C) und drei Sauerstoffatomen (O).
Molmasse von Nickelcarbonat
Die Molmasse von Nickelmonocarbonat (NiCO3) beträgt etwa 118,7 Gramm pro Mol. Dieser Wert wird durch Summieren der Atommassen seiner Bestandteile ermittelt.
Siedepunkt von Nickelcarbonat
Nickelmonocarbonat hat keinen ausgeprägten Siedepunkt, da es dazu neigt, sich vor Erreichen des Siedepunkts zu zersetzen. Beim Erhitzen zerfällt es in Nickeloxid, Kohlendioxid und Sauerstoff.
Schmelzpunkt von Nickelcarbonat
Nickelmonocarbonat hat einen Schmelzpunkt von etwa 200 °C (392 °F). Bei dieser Temperatur geht es vom festen in den flüssigen Zustand über.
Dichte von Nickelcarbonat g/ml
Die Dichte von Nickelmonocarbonat beträgt etwa 3,6 Gramm pro Kubikzentimeter (g/cm³). Dieser Dichtewert gibt die Masse der Verbindung pro Volumeneinheit an.
Molekulargewicht von Nickelcarbonat
Das Molekulargewicht von Nickelmonocarbonat (NiCO3) beträgt etwa 118,7 Gramm pro Mol. Es wird durch Addition der Atomgewichte der Atome, aus denen es besteht, berechnet.
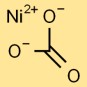
Struktur von Nickelcarbonat
Nickelmonocarbonat hat eine Grundstruktur, bei der ein zentrales Nickelatom in dreieckiger Anordnung an drei Sauerstoffatome gebunden ist. Dies bildet den Kern des Carbonations. Die Struktur wird durch ionische und kovalente Bindungen zusammengehalten.
Löslichkeit von Nickelcarbonat
Nickelmonocarbonat ist in Wasser schlecht löslich. Seine Löslichkeit nimmt zu, wenn der pH-Wert der Lösung sinkt. Es kann sich auch in sauren Lösungen lösen, die Substanzen wie Salzsäure enthalten.
Die Eigenschaften von Nickelmonocarbonat machen es für eine Vielzahl von Anwendungen nützlich. Aufgrund seiner Wasserunlöslichkeit eignet es sich für Anwendungen in Keramik und Pigmenten. Seine Zersetzung bei hohen Temperaturen trägt zu seiner Verwendung in katalytischen Prozessen bei.
| Aussehen | Einfarbig grün |
| Spezifisches Gewicht | 3,6 g/cm³ |
| Farbe | Grün |
| Geruch | Geruchlos |
| Molmasse | 118,7 g/Mol |
| Dichte | 3,6 g/cm³ |
| Fusionspunkt | 200 °C (392 °F) |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | Löslich in Säuren wie Salzsäure |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Sicherheit und Gefahren von Nickelcarbonat
Nickelmoncarbonat birgt potenzielle Sicherheitsrisiken. Es kann bei Kontakt Haut und Augen reizen und Rötungen und Beschwerden verursachen. Das Einatmen von Staub oder Dämpfen kann zu Reizungen der Atemwege oder Husten führen. Es wird empfohlen, vorsichtig damit umzugehen und entsprechende Schutzausrüstung wie Handschuhe und Brille zu tragen. Vermeiden Sie die Einnahme oder das Einatmen der Verbindung. Bei Exposition die betroffenen Stellen waschen und bei anhaltenden Symptomen einen Arzt aufsuchen. Um Risiken zu minimieren, sind ausreichende Belüftungs- und Eindämmungsmaßnahmen unerlässlich. Die Einhaltung der Sicherheitsprotokolle bei der Arbeit mit Nickelmonocarbonat ist entscheidend, um potenziellen Gesundheitsproblemen vorzubeugen und eine sichere Umgebung zu gewährleisten.
| Gefahrensymbole | Reizend, Gesundheitsgefährlich |
| Sicherheitsbeschreibung | Reizend; Kontakt und Einatmen vermeiden; Mit Vorsicht behandeln |
| UN-Identifikationsnummern | Nicht zugeschrieben |
| HS-Code | 2836.40.00 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Nicht klassifiziert |
| Toxizität | Kann Haut- und Augenreizungen verursachen; Reizung der Atemwege bei Einatmen |
Methoden zur Nickelcarbonat-Synthese
Nickelmonocarbonat kann auf verschiedene Weise synthetisiert werden. Ein üblicher Ansatz beinhaltet die Reaktion zwischen einem löslichen Nickelsalz (wie Nickelchlorid oder Nickelsulfat ) und einem löslichen Carbonatsalz (wie Natriumcarbonat) in Wasser. Beim Mischen der beiden Lösungen entsteht unlösliches Nickelmonocarbonat in Form eines grünen Niederschlags. Dieser Niederschlag wird dann filtriert, gewaschen und getrocknet, um das Endprodukt zu erhalten.
Eine andere Methode beinhaltet die Reaktion zwischen Nickeloxid oder Nickelhydroxid und Kohlendioxidgas in Gegenwart von Feuchtigkeit. Dies führt zur Bildung von Nickelmonocarbonat mit Wasser. Dieses Verfahren wird häufig industriell zur Herstellung von Nickelmonocarbonat eingesetzt.
Zusätzlich kann ein Fällungsprozess verwendet werden, indem eine Lösung eines löslichen Nickelsalzes mit einer Lösung eines löslichen Carbonatsalzes gemischt wird. Die resultierende Mischung wird gerührt und der gebildete Nickelmonocarbonat-Niederschlag wird gesammelt und behandelt.
Diese Synthesemethoden produzieren Nickelmonocarbonat für verschiedene Anwendungen wie Keramik, Katalysatoren und Pigmente. Eine sorgfältige Kontrolle der Reaktionsbedingungen und Reinigungsschritte ist entscheidend, um qualitativ hochwertige Nickelmonocarbonatprodukte zu erhalten.
Verwendung von Nickelcarbonat
Aufgrund seiner einzigartigen Eigenschaften findet Nickelmoncarbonat vielfältige Anwendungen. Einige wichtige Verwendungszwecke sind:
- Keramik- und Glasproduktion: Nickelmoncarbonat verleiht Keramik und Glas lebendige Farben für künstlerischen Ausdruck und industrielle Verwendung.
- Katalysator: Er dient als Katalysator oder Katalysatorvorläufer in verschiedenen chemischen Prozessen und erleichtert Oxidationsreaktionen durch die Freisetzung von Sauerstoff während der Zersetzung bei hohen Temperaturen.
- Galvanisieren: Die Verwendung von Nickelmonocarbonat als Vorläufer ermöglicht das Galvanisieren von Nickel auf verschiedenen Oberflächen und verbessert so das Erscheinungsbild der Oberfläche und die Korrosionsbeständigkeit.
- Batterieindustrie: In Batterietechnologien, insbesondere solchen auf Basis von Nickel, trägt es zu Kathodenmaterialien bei und unterstützt so die Weiterentwicklung von Batteriesystemen.
- Pigmente und Tinten: Nickelmonocarbonat ist maßgeblich an der Erzeugung eines Spektrums grüner Farbtöne in Pigmenten, Tinten und Farben beteiligt.
- Landwirtschaft: Seine Verwendung als Nährstoffquelle für Nickel in Düngemitteln fördert das Pflanzenwachstum und wird in der Landwirtschaft eingesetzt.
- Medizin: Obwohl selten, erforschen Forscher potenzielle medizinische Anwendungen aufgrund bestimmter Nickelverbindungen, insbesondere Nickelmonocarbonat, die antimikrobielle Eigenschaften aufweisen.
- Fotografie: Historisch gesehen hat es eine Rolle in Tonern für die Schwarz-Weiß-Fotografie gefunden und verstärkt Schattierungen und Kontraste.
- Textilien: Die Textilindustrie verwendet Nickelmonocarbonat, um die Absorption von Farbstoffen zu verbessern und Stoffen Farbe zu verleihen.
- Forschung und Bildung: Die chemischen Eigenschaften von Nickelmonocarbonat belegen seine Bedeutung in Chemielabors für pädagogische Demonstrationen, Experimente und Forschung.
Diese vielseitigen Anwendungen zeigen die Bedeutung von Nickelmonocarbonat in verschiedenen Branchen, von der Verbesserung der Ästhetik von Keramik bis hin zur Rolle in fortschrittlichen Technologien wie Batterien und Katalysatoren.
Fragen:
F: Welches Element ist am reaktivsten?
A: Natrium.
F: Welches nützliche Material entsteht durch die Mischung von Eisen mit Chrom, Kohlenstoff und Nickel?
A: Edelstahl.
F: Ist Nickelcarbonat wasserlöslich?
A: Nicht sehr löslich.
F: Wie viele Mol Kohlenstoff enthält Nickeltetracarbonyl?
A: Vier Maulwürfe.
F: Wie entferne ich die Vernickelung von Kohlenstoffstahl?
A: Verwendung geeigneter chemischer Abbeizmittel oder elektrochemischer Methoden.
F: Nettoionengleichung von Nickel(II)-nitrat und Natriumcarbonat?
A: Ni²⁺ + CO₃²⁻ → NiCO₃(s).
F: Rolle von Kohlenmonoxid bei der Nickelgewinnung?
A: Es fungiert als Reduktionsmittel, um Nickel aus seinen Erzen zu extrahieren.
F: Löslichkeit von Nickelmonocarbonat?
A: Geringe Löslichkeit in Wasser.
F: Ordnungszahlen von Kohlenstoff, Natrium und Nickel?
A: Kohlenstoff: 6, Natrium: 11, Nickel: 28.
F: Was passiert, wenn man Ammoniumcarbonat, Nickelchlorid und Wasser mischt?
A: Bildung von Nickelmonocarbonat-Niederschlag und Freisetzung von Ammoniumchloridgas.
