Zinkfluorid (ZnF2) ist eine chemische Verbindung. Es besteht aus Zink und Fluor. Aufgrund seiner einzigartigen Eigenschaften wird es in verschiedenen Branchen wie der Dental- und Elektronikbranche eingesetzt.
| IUPAC-Name | Zinkfluorid |
| Molekularformel | ZnF2 |
| CAS-Nummer | 7783-49-5 |
| Synonyme | Zinkdifluorid, Zink(II)fluorid |
| InChI | InChI=1S/2FH.Zn/h2*1H;/q;;+2/p-2 |
Eigenschaften von Zinkfluorid
Zinkfluorid-Formel
Die chemische Formel für Zinkdifluorid lautet ZnF2. Diese Formel bedeutet, dass jedes Zinkdifluoridmolekül aus einem Zinkatom (Zn) und zwei Fluoratomen (F) besteht.
Molmasse von Zinkfluorid
Die Molmasse von Zinkdifluorid (ZnF2) beträgt etwa 103,38 g/mol. Dieser Wert wird durch Addition der Atommassen eines Zinkatoms und zweier Fluoratome berechnet.
Siedepunkt von Zinkfluorid
Zinkdifluorid hat einen Siedepunkt von etwa 872 °C (1602 °F). Dies ist die Temperatur, bei der die Verbindung unter normalem Atmosphärendruck von flüssig in gasförmig übergeht.
Schmelzpunkt von Zinkfluorid
Der Schmelzpunkt von Zinkdifluorid liegt bei etwa 872 °C (1602 °F). Bei dieser Temperatur wird die feste Form von Zinkdifluorid flüssig.
Dichte von Zinkfluorid g/ml
Die Dichte von Zinkdifluorid beträgt etwa 4,95 g/ml. Dieser Wert stellt die Masse der Verbindung pro Volumeneinheit dar und gibt ihre Schwere an.
Molekulargewicht von Zinkfluorid
Das Molekulargewicht von Zinkdifluorid (ZnF2) beträgt etwa 103,38 g/mol. Dieser Wert stellt die Summe der Atomgewichte aller Atome in einem Molekül der Verbindung dar.
Struktur von Zinkfluorid
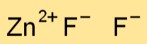
Zinkdifluorid (ZnF2) hat eine Kristallstruktur, in der jedes Zinkatom von vier Fluoridionen umgeben ist, die in einer tetraedrischen Anordnung angeordnet sind. Diese Anordnung trägt zur Stabilität der Verbindung bei.
Löslichkeit von Zinkfluorid
Zinkdifluorid weist eine begrenzte Wasserlöslichkeit auf. Es ist schwer löslich, was bedeutet, dass sich nur eine kleine Menge der Verbindung in Wasser auflösen und eine Lösung bilden kann. Diese Eigenschaft ist für verschiedene industrielle Anwendungen und chemische Prozesse wichtig.
| Aussehen | Weißer Feststoff |
| Spezifisches Gewicht | 4,95 g/cm³ |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 103,38 g/Mol |
| Dichte | 4,95 g/ml |
| Fusionspunkt | 872 °C (1602 °F) |
| Siedepunkt | 872 °C (1602 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Begrenzte Löslichkeit |
| Löslichkeit | Schwer löslich, nur eine kleine Menge kann sich in Wasser lösen |
| Dampfdruck | Nicht genau definiert |
| Wasserdampfdichte | Nicht genau definiert |
| pKa | Unzutreffend |
| pH-Wert | Neutral |
Sicherheit und Gefahren von Zinkfluorid
Zinkdifluorid (ZnF2) wirft bestimmte Sicherheitsbedenken auf. Es ist wichtig, mit dieser Verbindung vorsichtig umzugehen. Vermeiden Sie das Einatmen oder Verschlucken, da dies zu Reizungen der Atemwege und des Magen-Darm-Trakts führen kann. Tragen Sie beim Arbeiten mit ZnF2 geeignete persönliche Schutzausrüstung wie Handschuhe und Schutzbrille, um Haut- und Augenkontakt zu vermeiden. Bei versehentlichem Kontakt die betroffenen Stellen mit reichlich Wasser abspülen. Lagern Sie Zinkdifluorid fern von unverträglichen Materialien und Wärmequellen. Obwohl es nicht sehr giftig ist, ist es ratsam, die richtigen Handhabungsverfahren einzuhalten und für eine gute Belüftung zu sorgen, um potenzielle Risiken im Zusammenhang mit seiner Verwendung zu minimieren.
| Gefahrensymbole | Ätzend, reizend, akut giftig |
| Sicherheitsbeschreibung | Mit Vorsicht behandeln. Einatmen und Verschlucken vermeiden. Schutzausrüstung tragen. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 28261900 |
| Gefahrenklasse | Nicht klassifiziert |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität |
Methoden zur Synthese von Zinkfluorid
Zinkdifluorid kann auf verschiedene Weise synthetisiert werden. Ein gängiger Ansatz beinhaltet die Reaktion zwischen Zinkoxid (ZnO) und Flusssäure (HF) . Bei dieser Methode wird ZnO mit HF vermischt, wodurch Zinkdifluorid und Wasser entstehen. Eine andere Methode beinhaltet die Reaktion zwischen Zinkcarbonat (ZnCO3) und Flusssäure. Zinkcarbonat reagiert mit HF unter Bildung von Zinkdifluorid, Kohlendioxid und Wasser.
Darüber hinaus kann Zinkdifluorid auch durch Reaktion von Zinkmetall mit Fluorgas (F2) bei hohen Temperaturen hergestellt werden. Bei dieser Reaktion entsteht unter Freisetzung von Wärme direkt Zinkdifluorid.
Darüber hinaus können Fällungsmethoden eingesetzt werden, bei denen lösliche Zinksalze mit löslichen Fluoridsalzen zu unlöslichem Zinkdifluorid reagieren, das dann abgetrennt und gesammelt werden kann.
Aufgrund der Reaktivität der beteiligten Chemikalien ist bei diesen Syntheseprozessen Vorsicht geboten. Um eine erfolgreiche und sichere Synthese von Zinkdifluorid zu gewährleisten, müssen geeignete Sicherheitsmaßnahmen und Geräte eingesetzt werden.
Verwendung von Zinkfluorid
Zinkdifluorid (ZnF2) findet aufgrund seiner einzigartigen Eigenschaften vielseitige Anwendungen in verschiedenen Branchen. Hier sind seine Hauptverwendungen:
- Zahnpflege: Stärken Sie den Zahnschmelz und verbessern Sie die Mundhygiene durch die Einarbeitung von ZnF2 in Zahnpastaformulierungen.
- Optik und Beschichtungen: Verbessern Sie die Antireflexionseigenschaften von Linsen und verbessern Sie die Lichtdurchlässigkeit durch die Verwendung von ZnF2 in optischen Beschichtungen.
- Elektronik: Integrieren Sie ZnF2 in Dünnschichttransistor-Displays (TFT), um transparente leitfähige Filme zu erzeugen.
- Fluorid-Ionenquelle: Verwenden Sie ZnF2 als Fluorid-Ionenquelle in Elektrolysezellen, um die Produktion reaktiver Metalle wie Aluminium zu unterstützen.
- Chemische Synthese: Verwenden Sie ZnF2 als Katalysator und Fluorierungsmittel in verschiedenen chemischen Reaktionen, um die Synthese von Pharmazeutika und Agrochemikalien zu erleichtern.
- Verzinken: Tragen Sie ZnF2 in Metallveredelungsprozessen auf Metalloberflächen auf, die zur Verzinkung bereit sind, um die Haftung und Haltbarkeit zu verbessern.
- Infrarotfenster: Stellen Sie Infrarot-Sensorfenster und Wärmebildsysteme aus ZnF2 her, da es im Infrarotbereich transparent ist.
- Laseranwendungen: Verwenden Sie ZnF2 als Laserverstärkungsmedium, um zur Entwicklung abstimmbarer Laser für wissenschaftliche und industrielle Zwecke beizutragen.
- Kristallwachstum: Integrieren Sie ZnF2 in Kristallwachstumsprozesse für Halbleiter und andere elektronische Komponenten.
- Chemische Forschung: Verwendung von ZnF2 als Reaktant und Reaktant in verschiedenen chemischen Reaktionen im Labormaßstab, was die Erforschung neuer Verbindungen erleichtert.
Diese vielfältigen Anwendungen unterstreichen die Bedeutung von Zinkdifluorid in der modernen Technologie, Fertigung und wissenschaftlichen Forschung in zahlreichen Bereichen.
Fragen:
F: Wie lautet die chemische Formel von Zinkfluorid?
A: Die chemische Formel für Zinkdifluorid lautet ZnF2.
F: Wie lautet die Formel für Zink(II)fluorid?
A: Die Formel für Zink(II)-difluorid lautet ZnF2.
F: Wie lautet die Formel der ionischen Verbindung, die aus Zink- und Fluoridionen gebildet wird?
A: Die Formel der aus Zn+2 und Fluoridionen gebildeten ionischen Verbindung lautet ZnF2.
F: Was kann aufgrund eines Zink-, Jod- oder Fluoridmangels passieren?
A: Zn-, Jod- oder Fluoridmangel kann zu einer Vielzahl von Gesundheitsproblemen führen und den Stoffwechsel, die Schilddrüsenfunktion und die Zahngesundheit beeinträchtigen.
F: Für welche der folgenden Einrichtungen gibt es keine RDA? A. Eisen B. Zink c. Jod d. Fluorid
A: Für Fluorid gibt es keine empfohlene Tagesdosis (RDA).
F: Wie kann Zinkfluorid einen Menschen beeinflussen?
A: Zinkdifluorid kann durch Verschlucken, Einatmen oder potenziellen Hautkontakt auf den Menschen wirken und möglicherweise Reizungen oder Toxizität verursachen.
F: Ist ZnF2 ionisch oder molekular?
A: ZnF2 ist eine ionische Verbindung.
F: Warum ist es ZnF2 und nicht ZnF?
A: ZnF2 zeigt an, dass jedes Zn-Atom an zwei F-Ionen gebunden ist, wodurch die richtige Stöchiometrie entsteht.
F: Bilden ZnF2 und NaOH einen Niederschlag?
A: Ja, ZnF2 und NaOH können einen weißen Niederschlag von Zinkhydroxid (Zn(OH)2) bilden.
F: Ist ZnF2 löslich?
A: ZnF2 ist in Wasser schlecht löslich.
F: Wie heißt die Verbindung mit der Formel ZnF2?
A: Die Verbindung mit der Formel ZnF2 heißt Zinkdifluorid.
F: Der Ksp von ZnF2 beträgt 3,0 × 10⁻² bei 25 °C. Was ist ΔG°?
A: Der Wert von ΔG° kann basierend auf dem gegebenen Ksp-Wert und der Temperatur unter Verwendung der entsprechenden thermodynamischen Gleichung berechnet werden.
F: Was ist ZnF2?
A: ZnF2 ist die chemische Formel für Zinkdifluorid, eine Verbindung aus Zink und Fluor.
F: Wie viele Mol enthält ZnF2?
A: Die Anzahl der Mol in ZnF2 hängt von der gegebenen Masse und der Molmasse der Verbindung ab.
