Zinksulfid (ZnS) ist eine Verbindung aus Zink und Schwefel. Es wird in verschiedenen Anwendungen eingesetzt, darunter Leuchtstoffe, Optoelektronik und Leuchtstoffe für LED-Anzeigen.
| IUPAC-Name | Zinksulfid |
| Molekularformel | ZnS |
| CAS-Nummer | 1314-98-3 |
| Synonyme | Sphalerit, Blende, Zinkblende, Wurtzit |
| InChI | InChI=1S/S.Zn |
Eigenschaften von Zinksulfid
Zinksulfid-Formel
Die chemische Formel für Zinksulfid lautet ZnS und gibt die Zusammensetzung aus Zink- (Zn) und Schwefelatomen (S) an. Aufgrund seiner einzigartigen Eigenschaften ist diese Verbindung ein entscheidender Bestandteil verschiedener industrieller und wissenschaftlicher Anwendungen.
Molmasse von Zinksulfid
Zinksulfid hat eine Molmasse von etwa 97,45 Gramm pro Mol. Dieser Wert stellt die kombinierten Atommassen der Zink- und Schwefelatombestandteile in einem einzelnen ZnS-Molekül dar.
Siedepunkt von Zinksulfid
Zinksulfid hat keinen eindeutigen Siedepunkt, da es sich beim Erhitzen eher zersetzt als einen echten Siedeprozess durchläuft. Diese Eigenschaft ergibt sich aus seinen chemischen Eigenschaften.
Schmelzpunkt von Zinksulfid
Zinksulfid hat einen Schmelzpunkt von etwa 1.850 Grad Celsius (3.362 Grad Fahrenheit). Aufgrund seines hohen Schmelzpunkts eignet es sich für verschiedene Hochtemperaturanwendungen.
Dichte von Zinksulfid g/ml
Die Dichte von Zinksulfid variiert je nach Kristallform. Im Allgemeinen liegt seine Dichte zwischen 3,98 und 4,09 Gramm pro Kubikzentimeter (g/cm³). Dieser Dichtebereich trägt zu seiner Verwendung in optischen Materialien bei.
Molekulargewicht von Zinksulfid
Das Molekulargewicht von Zinksulfid, berechnet durch Addition der Atommassen seiner Bestandteile, beträgt etwa 97,45 Gramm pro Mol. Dieser Wert ist entscheidend für die Bestimmung der ZnS-Menge in einer bestimmten Probe.
Struktur von Zinksulfid
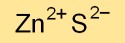
Zinksulfid kommt in verschiedenen Kristallstrukturen vor, hauptsächlich als kubische Zinkblende (auch als Sphalerit bekannt) und hexagonaler Wurtzit. Diese Anordnung der Atome bestimmt seine physikalischen und optischen Eigenschaften.
Löslichkeit von Zinksulfid
Zinksulfid ist in Wasser schlecht löslich und daher praktisch unlöslich. Diese Eigenschaft ist auf die starken Bindungen zwischen Zink- und Schwefelatomen zurückzuführen, die zu einer begrenzten Auflösung in wässrigen Lösungen führen. Unter bestimmten Bedingungen kann es jedoch in bestimmten Säuren oder Laugen gelöst werden.
| Aussehen | Solide |
| Spezifisches Gewicht | 3,98 – 4,09 g/cm³ |
| Farbe | Weiß, Gelb, Braun, Schwarz |
| Geruch | Geruchlos |
| Molmasse | ~97,45 g/Mol |
| Dichte | 3,98 – 4,09 g/cm³ |
| Fusionspunkt | ~1850°C (~3362°F) |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Praktisch unlöslich |
| Löslichkeit | Unter bestimmten Bedingungen in Säuren und Laugen löslich |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Unzutreffend |
| pKa | ~4,7 |
| pH-Wert | ~7 (neutral) |
Sicherheit und Gefahren von Zinksulfid
Zinksulfid weist eine geringe akute Toxizität auf, kann jedoch beim Erhitzen giftiges Schwefeldioxid freisetzen. Unter normalen Handhabungsbedingungen gilt es im Allgemeinen als sicher. Das Einatmen von Staub oder Dämpfen kann jedoch zu Reizungen der Atemwege führen. Kontakt mit Haut und Augen vermeiden. Bei Kontakt gründlich ausspülen und bei anhaltender Reizung einen Arzt konsultieren. Feuer oder übermäßige Hitze können zur Zersetzung führen und gefährliche Gase freisetzen. Getrennt von unverträglichen Materialien lagern. Gehen Sie vorsichtig damit um, tragen Sie geeignete Schutzausrüstung und arbeiten Sie in gut belüfteten Bereichen, um die Sicherheit zu gewährleisten und mögliche Gefahren im Zusammenhang mit Zinksulfid zu vermeiden.
| Gefahrensymbole | Keiner |
| Sicherheitsbeschreibung | Geringe akute Toxizität; setzt beim Erhitzen giftiges Schwefeldioxidgas frei; mit Vorsicht behandeln |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 2830.90.10 |
| Gefahrenklasse | Nicht als gefährlich eingestuft |
| Verpackungsgruppe | Unzutreffend |
| Toxizität | Geringe Toxizität; Reizung der Atemwege durch Staub oder Dämpfe; mit Vorsicht behandeln |
Methoden zur Zinksulfid-Synthese
Zinksulfid kann auf verschiedene Weise synthetisiert werden. Ein gängiger Ansatz besteht darin, die Gase Zinkoxid (ZnO) und Schwefelwasserstoff (H2S) bei erhöhten Temperaturen zur Reaktion zu bringen. Die Reaktion läuft wie folgt ab:
ZnO (s) + H2S (g) → ZnS (s) + H2O (g)
Eine andere Methode beinhaltet die Reaktion zwischen Zinkchlorid (ZnCl2) und Schwefelwasserstoffgas:
ZnCl2 (aq) + H2S (g) → ZnS (s) + 2 HCl (g)
Alternativ können Zinksulfid-Nanopartikel mithilfe von Fällungsmethoden synthetisiert werden. Dabei werden lösliche Zinksalze mit löslichen Sulfidsalzen unter kontrollierten Bedingungen vermischt, was zur Bildung von Zinksulfid-Nanopartikeln führt. In einigen Fällen werden organische Verbindungen als Verkappungsmittel verwendet, um die Partikelgröße und -stabilität zu steuern.
Zinksulfid kann auch durch Reaktion von metallischem Zink mit elementarem Schwefel hergestellt werden. Um die Reaktion auszulösen, werden die beiden Stoffe gemeinsam erhitzt:
Zn(s) + S(s) → ZnS(s)
Diese Methoden bieten Vielseitigkeit bei der Herstellung von Zinksulfid mit unterschiedlichen Eigenschaften für verschiedene Anwendungen, wie Optoelektronik, Leuchtstoffe usw.
Verwendung von Zinksulfid
Aufgrund seiner einzigartigen Eigenschaften findet Zinksulfid vielfältige Anwendungen in verschiedenen Branchen. Hier sind seine bemerkenswerten Verwendungszwecke:
- Optische Beschichtungen: Die Transparenz von Zinksulfid im Infrarotbereich macht es zu einem wertvollen Material für optische Beschichtungen, Linsen und Fenster in Wärmebildsystemen und Sensoren.
- Lumineszierende Materialien: Es dient als Wirtsmaterial zur Herstellung lumineszierender Verbindungen, wie z. B. kupferdotiertes Zinksulfid für im Dunkeln leuchtende Anwendungen.
- Halbleiteranwendungen: In Dünnschichttransistoren und anderen Halbleiterbauelementen spielen Zinksulfidfilme in elektronischen Bauteilen eine Rolle.
- Leuchtstoffe für LED-Anzeigen: LED-Anzeigen verwenden Zinksulfid-Leuchtstoffe, um Farbe und Helligkeit zu verbessern.
- Röntgen- und Gammastrahlendetektion: Szintillationsdetektoren nutzen die szintillierenden Eigenschaften von Zinksulfid zur Detektion von Röntgen- und Gammastrahlen.
- Pigmente und Farben: Weiße Pigmente in Farben, Beschichtungen und Druckfarben verwenden bestimmte Formen von Zinksulfid wie Zinkweiß oder Lithopon.
- Fluoreszierende Marker: In biologischen Anwendungen funktionalisieren Forscher Zinksulfid-Nanopartikel für Fluoreszenzmarker in bildgebenden Untersuchungen.
- Solarzellen: Wissenschaftler untersuchen Zinksulfid-Nanopartikel, um ihr Potenzial zur Verbesserung der Lichtabsorption in Photovoltaik-Solarzellen zu ermitteln.
- Katalyse: Forscher erforschen seine Halbleiternatur und untersuchen die katalytischen Eigenschaften von Zinksulfid in verschiedenen chemischen Reaktionen.
- Infrarotfenster: Optische Geräte wie Kameras, Teleskope und Sensoren, die Zinksulfid für Infrarotfenster enthalten.
Die Vielseitigkeit von Zinksulfid ergibt sich aus seiner Fähigkeit, Lumineszenz, Transparenz und Halbleiterverhalten zu zeigen. Seine maßgeschneiderten Anwendungen tragen wesentlich zu Bereichen wie Optik, Elektronik, Energie und Materialwissenschaften bei.
Fragen:
F: Wie lautet die Formel für Zinksulfid?
A: Die Formel für Zinksulfid lautet ZnS.
F: Ist Zinksulfid löslich?
A: Zinksulfid ist im Allgemeinen in Wasser unlöslich.
F: Ist ZnS wasserlöslich?
A: Nein, ZnS ist nicht wasserlöslich.
F: Zinksulfid enthält 67,1 Masse-% Zink. Wie groß ist der Massenanteil von Schwefel in Zinksulfid?
A: Der Massenanteil von Schwefel in Zinksulfid beträgt 32,9 %.
F: Wie kann man Zinkchlorid von Zinksulfid trennen?
A: Zinkchlorid und Zinksulfid können durch Auflösen des Zinkchlorids in Wasser getrennt werden, wobei das unlösliche Zinksulfid zurückbleibt.
F: Ist Zinksulfid ionisch?
A: Ja, Zinksulfid ist hauptsächlich ionisch.
F: Welche Art von stöchiometrischem Defekt stellt ZnS dar?
A: Zinksulfid kann stöchiometrische Defekte vom Frenkel-Typ aufweisen.
F: Was ist ZnS?
A: ZnS ist die chemische Formel für Zinksulfid, eine Verbindung aus Zink und Schwefel.
F: Was ist der minimale pH-Wert, der erforderlich ist, um die Ausfällung von ZnS zu verhindern?
A: Der erforderliche Mindest-pH-Wert zur Verhinderung der ZnS-Ausfällung beträgt etwa 4,7.
F: Dieses Bild zeigt die kubische Elementarzelle für ZnS. Wie viele Zn²⁺-Ionen befinden sich in dieser kubischen Zelle?
A: In der kubischen Zelle von ZnS gibt es vier Zn²⁺-Ionen.
F: Ist ZnS ionisch oder kovalent?
A: ZnS gilt hauptsächlich als ionisch.
F: Welche Art von Reaktion ist Zn + S = ZnS?
A: Die Reaktion Zn + S = ZnS ist eine Synthese- oder Kombinationsreaktion.
