Zinkbromid (ZnBr2) ist eine chemische Verbindung. Es besteht aus den Elementen Zink und Brom. Es wird in verschiedenen Anwendungen wie Ölbohrflüssigkeiten und Elektrolytlösungen eingesetzt.
| IUPAC-Name | Zinkbromid |
| Molekularformel | ZnBr2 |
| CAS-Nummer | 7699-45-8 |
| Synonyme | Zinkdibromid, Zink(II)bromid |
| InChI | InChI=1S/2BrH.Zn/h2*1H;/q;;+2/p-2 |
Eigenschaften von Zinkbromid
Zinkbromid-Formel
Die Formel für Zinkdibromid lautet ZnBr2. Es besteht aus einem Zinkatom (Zn) und zwei Bromatomen (Br). Diese Verbindung entsteht durch die Kombination dieser Elemente.
Molmasse von Zinkbromid
Zinkdibromid hat eine Molmasse von etwa 225,19 g/mol. Dieser Wert wird berechnet, indem die Atommassen eines Zinkatoms und zweier Bromatome in der Verbindung addiert werden.
Siedepunkt von Zinkbromid
Der Siedepunkt von Zinkdibromid liegt bei etwa 464 °C (867 °F). Bei dieser Temperatur geht die Verbindung vom flüssigen in den gasförmigen Zustand über. Aufgrund seines hohen Siedepunkts ist es für bestimmte industrielle Anwendungen geeignet.
Schmelzpunkt von Zinkbromid
Zinkdibromid hat einen Schmelzpunkt von etwa 394 °C (741 °F). Dies ist die Temperatur, bei der die feste Verbindung in den flüssigen Zustand übergeht. Der relativ hohe Schmelzpunkt ist auf die starken Wechselwirkungen zwischen den Zink- und Bromatomen zurückzuführen.
Dichte von Zinkbromid g/ml
Die Dichte von Zinkdibromid beträgt etwa 4,20 g/ml. Dieser Wert gibt die Masse der Verbindung pro Volumeneinheit an. Die hohe Dichte lässt darauf schließen, dass Zinkdibromid im Verhältnis zu seinem Volumen relativ schwer ist.
Molekulargewicht von Zinkbromid
Das Molekulargewicht von Zinkdibromid beträgt etwa 225,19 g/mol. Dieser Wert stellt die Summe der Atomgewichte aller Atome in einem einzelnen Molekül der Verbindung dar.
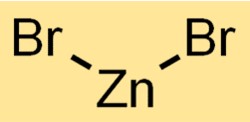
Struktur von Zinkbromid
Zinkdibromid hat eine kristalline Struktur. Es bildet ein Netzwerk, in dem Zinkkationen (Zn2+) in einem sich wiederholenden Muster von Bromidanionen (Br-) umgeben sind. Diese Struktur trägt zu den Eigenschaften und dem Verhalten der Verbindung bei.
Löslichkeit von Zinkbromid
Zinkdibromid ist in Wasser sehr gut löslich. Bei Zugabe zu Wasser zerfällt es in Zinkkationen und Bromidanionen und bildet eine Lösung. Diese Löslichkeit ist in einer Vielzahl von Anwendungen von Vorteil, einschließlich der Verwendung als Elektrolyt in Batterien und bei der Formulierung von Bohrflüssigkeiten für die Erdölindustrie.
| Aussehen | Weißer Feststoff |
| Spezifisches Gewicht | 4,20 g/ml |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | 225,19 g/Mol |
| Dichte | 4,20 g/ml |
| Fusionspunkt | 394 °C (741 °F) |
| Siedepunkt | 464 °C (867 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Sehr gut löslich, dissoziiert in Zinkkationen und Bromidanionen |
| Löslichkeit | In Wasser löslich |
| Dampfdruck | Nicht genau definiert |
| Wasserdampfdichte | Unzutreffend |
| pKa | ~3,8 |
| pH-Wert | Säure |
Sicherheit und Gefahren von Zinkbromid
Zinkdibromid birgt einige Sicherheitsrisiken. Bei Kontakt kann es zu Haut- und Augenreizungen kommen. Das Einatmen von Staub oder Dämpfen kann zu Atembeschwerden führen. Es ist wichtig, vorsichtig damit umzugehen und Schutzausrüstung wie Handschuhe und Brille zu tragen. Bei Hautkontakt mit Wasser abwaschen und bei anhaltender Reizung einen Arzt aufsuchen. Bei Verschlucken sofort einen Arzt aufsuchen. Halten Sie es von unverträglichen Materialien sowie starken Säuren und Basen fern. An einem gut belüfteten Ort aufbewahren, fern von offenen Flammen oder Wärmequellen. Insgesamt ist es wichtig, beim Umgang mit Zinkdibromid die richtigen Sicherheitsmaßnahmen zu befolgen, um potenzielle Risiken zu vermeiden.
| Gefahrensymbole | Ätzend, Gesundheitsschädlich beim Verschlucken |
| Sicherheitsbeschreibung | Kontakt mit Haut und Augen vermeiden. Tragen Sie Schutzkleidung und Handschuhe. Bei Kontakt gründlich ausspülen. Das Einatmen von Staub/Dampf kann zu Reizungen der Atemwege führen. An einem gut belüfteten Ort aufbewahren. Freisetzung in die Umwelt vermeiden. Entsorgen Sie es ordnungsgemäß. |
| UN-Identifikationsnummern | UN3264 |
| HS-Code | 28275900 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | II |
| Toxizität | Mäßig giftig |
Methoden zur Synthese von Zinkbromid
Zinkdibromid kann auf verschiedene Weise synthetisiert werden. Eine übliche Methode ist die Reaktion von Zinkoxid (ZnO) mit Bromwasserstoffsäure (HBr) . Bei der Reaktion entstehen Zinkdibromid und Wasser:
ZnO + 2HBr → ZnBr2 + H2O
Ein weiterer Ansatz ist die direkte Reaktion von metallischem Zink mit gasförmigem Brom (Br2). Diese Methode ergibt Zinkdibromid:
Zn + Br2 → ZnBr2
Zinkdibromid kann auch durch Behandlung von Zinkcarbonat (ZnCO3) mit Bromwasserstoffsäure hergestellt werden:
ZnCO3 + 2HBr → ZnBr2 + H2O + CO2
Darüber hinaus kann die Reaktion von Zinkoxid mit Bromwasserstoffgas (HBr) Zinkdibromid erzeugen:
ZnO + 2HBr → ZnBr2 + H2O
Diese Synthesemethoden führen zur Bildung von Zinkdibromid, einer essentiellen Verbindung mit verschiedenen industriellen Anwendungen, einschließlich ihrer Verwendung in Elektrolytlösungen und Ölbohrflüssigkeiten.
Verwendungsmöglichkeiten von Zinkbromid
Aufgrund seiner einzigartigen Eigenschaften findet Zinkdibromid branchenübergreifend verschiedene wichtige Anwendungen:
- Chemische Synthese: ZnBr2 dient als Katalysator bei chemischen Reaktionen. Es fördert spezifische Reaktionen in der organischen Synthese und in pharmazeutischen Herstellungsprozessen.
- Fotografie: In einigen fotografischen Prozessen fungiert ZnBr2 als lichtempfindliches Material und trägt zur Herstellung von Fotopapieren und Filmen bei.
- Öl- und Gasindustrie: ZnBr2 spielt eine zentrale Rolle in Öl- und Gasbohrflüssigkeiten, da es den Druck aufrechterhält, Bohrlochausbrüche verhindert und Bohrungen stabilisiert.
- Batterieelektrolyt: Einige Batterietypen, darunter Zink-Brom-Durchflussbatterien, verwenden ZnBr2 als Elektrolyt und dienen in Energiespeicher- und Notstromsystemen.
- Medizinische Innovationen: Forscher erforschen das Potenzial von ZnBr2 in Pharmazeutika und Medikamenten aufgrund seiner antimikrobiellen Eigenschaften und erwägen Anwendungen in der Wundheilung und Infektionskontrolle.
- Textilverbesserung: ZnBr2 findet beim Färben und Bedrucken von Textilien Verwendung, indem es dazu beiträgt, bestimmte Farbstoffe an Stoffe zu binden und so die Farbechtheit zu verbessern.
- Flammhemmende Formulierungen: ZnBr2 wird als Additiv in flammhemmenden Formulierungen für Kunststoffe und Textilien eingesetzt und reduziert wirksam die Entflammbarkeit dieser Materialien.
- Metalloberflächenbehandlung: ZnBr2 ist an der Metalloberflächenbehandlung beteiligt und wird bei Reinigungs- und Ätzprozessen verwendet, die Oberflächen für nachfolgende Beschichtungen oder Behandlungen vorbereiten.
Die Vielseitigkeit von ZnBr2 macht es zu einem wertvollen Stoff in verschiedenen Bereichen und trägt zum technologischen Fortschritt und zu industriellen Prozessen bei.
Fragen:
F: Ist Zinkbromid löslich?
A: Ja, Zinkdibromid ist gut wasserlöslich.
F: Ist Zinkbromid ionisch oder kovalent?
A: Zinkdibromid ist eine ionische Verbindung.
F: Wie sieht Zinkbromid aus?
A: Zinkdibromid erscheint als weißer kristalliner Feststoff.
F: Wie lautet die Formel für Zinkbromid?
A: Die Formel für Zinkdibromid lautet ZnBr2.
F: Ist ZnBr2 wasserlöslich?
A: Ja, ZnBr2 ist wasserlöslich.
F: Was ist ZnBr2?
A: ZnBr2 ist eine chemische Verbindung, Zinkdibromid.
F: Ist ZnBr2 ionisch oder molekular?
A: ZnBr2 ist ionischer Natur.
F: Welche Masse ZnBr2 könnte man aus 1,00 g Zink herstellen?
A: Aus 1,00 g Zink können Sie 1,76 g ZnBr2 herstellen.
F: Löst sich ZnBr2 vollständig in Wasser auf?
A: Ja, ZnBr2 löst sich vollständig in Wasser.
F: Welche Produkte entstehen an der Kathode bei der Elektrolyse einer wässrigen Lösung von ZnBr2?
A: An der Kathode entsteht bei der Elektrolyse von ZnBr2 metallisches Zink.
F: Was bleibt übrig, wenn ZnBr2 in Wasser gelöst wird?
A: Wenn ZnBr2 in Wasser gelöst wird, verbleiben Zn²⁺-Ionen und Bromidionen (Br⁻) in der Lösung.
