Kupferacetat (Cu(CH3COO)2) ist eine blaugrüne kristalline Verbindung. Es entsteht, wenn Kupfer mit Essigsäure reagiert. Es findet Anwendung in verschiedenen Branchen, beispielsweise als Katalysatoren und Fungizide.
| IUPAC-Name | Kupfer(II)acetat |
| Molekularformel | Cu(CH3COO)2 |
| CAS-Nummer | 142-71-2 |
| Synonyme | Kupferacetat, Kupfersalz der Essigsäure, Kupferdiacetat |
| InChI | InChI=1S/2C2H4O2.Cu/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Eigenschaften von Kupferacetat
Kupferacetat-Formel
Kupferacetat hat die chemische Formel Cu(CH3COO)2. Es besteht aus einem Kupferatom (Cu), das an zwei Acetatgruppen (CH3COO) gebunden ist. Die Formel gibt das Verhältnis der Elemente in der Verbindung an.
Molmasse von Kupferacetat
Die Molmasse von Kupferacetat kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Kupfer (Cu) hat eine Molmasse von 63,55 g/mol, während Acetat (CH3COO) eine Molmasse von 59,04 g/mol hat. Somit beträgt die Molmasse von Kupferacetat 181,63 g/mol.
Siedepunkt von Kupferacetat
Aufgrund seiner thermischen Instabilität zersetzt sich Kupferacetat vor Erreichen des Siedepunkts. Sein Siedepunkt ist daher nicht genau definiert. Stattdessen zersetzt es sich, wenn es stark erhitzt wird.
Schmelzpunkt von Kupferacetat
Kupferacetat schmilzt typischerweise zwischen 115 °C und 120 °C (239 °F und 248 °F). Der Schmelzpunkt kann je nach Reinheit der Verbindung leicht variieren.
Dichte von Kupferacetat g/ml
Die Dichte von Kupferacetat beträgt etwa 1,882 g/ml. Dieser Wert entspricht der Masse an Kupferacetat pro Volumeneinheit. Die Dichte kann je nach Temperatur- und Druckschwankungen variieren.
Molekulargewicht von Kupferacetat
Das aus der Formel berechnete Molekulargewicht von Kupferacetat beträgt 181,63 g/mol. Es stellt die Summe der Atomgewichte aller in einem Kupferacetatmolekül vorhandenen Atome dar.
Struktur aus Kupferacetat
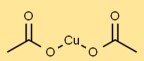
Kupferacetat weist in fester Form eine Kristallgitterstruktur auf. Kupferatome sind mit Acetatgruppen koordiniert und bilden so eine stabile Anordnung. Aufgrund seiner Koordinationsgeometrie erscheint es als blaugrüne Kristalle.
Löslichkeit von Kupferacetat
Kupferacetat ist in Wasser mäßig löslich. Aufgrund der Anwesenheit von Acetationen kann es sich in polaren Lösungsmitteln lösen. Allerdings kann die Löslichkeit begrenzt sein und die Auflösung kann durch Temperatur und pH-Wert beeinflusst werden.
| Aussehen | Blaugrüner kristalliner Feststoff |
| Spezifisches Gewicht | 1.882 g/ml |
| Farbe | Blau Grün |
| Geruch | Geruchlos |
| Molmasse | 181,63 g/Mol |
| Dichte | 1.882 g/ml |
| Fusionspunkt | 115 °C – 120 °C (239 °F – 248 °F) |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Mäßige Löslichkeit in Wasser |
| Löslichkeit | Löslich in polaren Lösungsmitteln, schwer löslich in Ether und Glycerin |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Säure (ca. 4-5) |
Sicherheit und Gefahren von Kupferacetat
Kupferacetat birgt bestimmte Sicherheitsbedenken und Gefahren. Es ist wichtig, vorsichtig damit umzugehen und die Sicherheitsprotokolle zu befolgen. Direkter Kontakt mit der Verbindung kann zu Haut- und Augenreizungen führen. Das Einatmen von Staub oder Dämpfen kann zu Atembeschwerden führen. Vermeiden Sie die Einnahme, da dies schädlich sein kann. Halten Sie es von inkompatiblen Materialien und Wärme- oder Zündquellen fern, um Brandgefahr zu vermeiden. Im Falle einer versehentlichen Exposition sind die betroffenen Stellen sofort abzuspülen und ein Arzt aufzusuchen. Lagern Sie Kupferacetat an einem gut belüfteten, sicheren Ort, fern von Kindern und Unbefugten. Tragen Sie bei der Arbeit mit dieser Verbindung stets geeignete persönliche Schutzausrüstung.
| Gefahrensymbole | Ätzend, akut giftig, reizend |
| Sicherheitsbeschreibung | Vermeiden Sie direkten Kontakt mit Haut und Augen. In einem gut belüfteten Bereich verwenden. Mit Vorsicht behandeln. |
| UN-Identifikationsnummern | Nicht zugeschrieben |
| HS-Code | 29152900 |
| Gefahrenklasse | 6.1 (Giftige Stoffe) |
| Verpackungsgruppe | III (Geringe Gefahr) |
| Toxizität | Kann Haut- und Augenreizungen verursachen. Einatmen kann zu Atembeschwerden führen. Vermeiden Sie die Einnahme. |
Methoden zur Synthese von Kupferacetat
Es gibt verschiedene Methoden zur Synthese von Kupferacetat.
Ein gängiger Ansatz beinhaltet die Reaktion zwischen Kupferoxid (CuO) oder Kupferhydroxid (Cu(OH)2) mit Essigsäure (CH3COOH). Sie kombinieren und verrühren die beiden Stoffe, wodurch Kupferacetat und Wasser entstehen. Eine andere Methode ist die Reaktion von Kupfercarbonat (CuCO3) mit Essigsäure, wodurch Kupferacetat, Kohlendioxid (CO2) und Wasser entstehen.
Eine alternative Synthesemethode beinhaltet die Reaktion von metallischem Kupfer mit einer Mischung aus Essigsäure und Wasserstoffperoxid (H2O2). Diese Reaktion führt zur Bildung von Kupferacetat und Wasser. Kupferacetat entsteht aus der Reaktion zwischen Kupfer(II)sulfat (CuSO4) und Calciumacetat (Ca(CH3COO)2. Bei dieser Reaktion entstehen Kupferacetat und Calciumsulfat (CaSO4).
Durch Erhitzen und Rückflusskochen einer Mischung aus Kupferpulver und Eisessig entsteht Kupferacetat. Dieser Prozess führt zur Bildung von Kupferacetat. Die Verfügbarkeit der Reagenzien und die gewünschte Reinheit des Endprodukts bestimmen die besonderen Vorteile jeder Methode.
Verwendung von Kupferacetat
Kupferacetat findet aufgrund seiner einzigartigen Eigenschaften vielseitige Anwendungen in verschiedenen Branchen. Hier sind einige wichtige Verwendungszwecke:
- Katalysator: Kupferacetat katalysiert viele organische Reaktionen, einschließlich der Synthese von Vinylacetat und Essigsäureanhydrid.
- Galvanisieren: Kupferacetat unterstützt Galvanisierungsprozesse, indem es Metallgegenständen eine dünne Kupferschicht verleiht und so deren Aussehen und Korrosionsbeständigkeit verbessert.
- Chemische Zwischenprodukte: Die Verbindung spielt eine entscheidende Rolle als Zwischenprodukt bei der Herstellung verschiedener Chemikalien wie Kupferoxid, Kupfernaphthenat und Kupferseifen.
- Holzschutzmittel: Kupferacetat wirkt als Holzschutzmittel und schützt das Holz vor Pilz- und Insektenbefall. Es wird häufig zur Konservierung von Eisenbahnschwellen und Strommasten verwendet.
- Fungizid: In der Landwirtschaft wird Kupferacetat als Fungizid zur Bekämpfung von Pilzkrankheiten in Nutzpflanzen, insbesondere im Wein- und Obstbau, eingesetzt.
- Pyrotechnik: Kupferacetat findet Anwendung in pyrotechnischen Formulierungen und erzeugt leuchtende blaue und grüne Farben in Feuerwerkskörpern und Fackeln.
- Textilfärben: Es fungiert als Beizmittel in Textilfärbeprozessen und erleichtert die Bindung von Farbstoffen an Fasern.
- Laborreagenz: Die Verbindung dient als Reagenz in Laborexperimenten für qualitative und quantitative Analysen.
- Analytische Chemie: Kupferacetat wird in der analytischen Chemie als Testreagenz zum Nachweis von Schwefelwasserstoffgas verwendet.
- Tierabwehrmittel: Es wirkt als Tierabwehrmittel, um bestimmte Schädlinge und Wildtiere aus bestimmten Bereichen fernzuhalten.
Die vielfältigen Anwendungen von Kupferacetat unterstreichen seine Bedeutung in verschiedenen Branchen, von der chemischen Synthese bis zur Landwirtschaft und darüber hinaus. Bei der Verwendung dieser Verbindung in verschiedenen Prozessen sind eine sorgfältige Handhabung und die Einhaltung von Sicherheitsvorkehrungen unerlässlich.
Fragen:
F: Ist Kupfer-II-Acetat kovalent?
A: Nein, Kupferacetat II ist eine ionische Verbindung.
F: Wie hoch ist der molare Extinktionskoeffizient bei 625 nm für diese Kupfer-II-Acetatlösung?
A: Der molare Extinktionskoeffizient bei 625 nm für Kupferacetat-II-Lösung ist spezifisch für die Lösungskonzentration und muss experimentell bestimmt werden.
F: Kann man Kupferacetat-Monohydrat in eine Klärgrube geben?
A: Aufgrund möglicher Gefahren und Umweltbedenken wird die Verwendung von Kupferacetat-Monohydrat als Klärgruben- oder Abflussreiniger nicht empfohlen.
F: Kommt es zu einer Reaktion, wenn wässrige Lösungen von Bariumacetat und Kupfer(II)-bromid kombiniert werden?
A: Ja, es kommt zu einer Reaktion, wenn wässrige Lösungen von Bariumacetat und Kupfer(II)-bromid kombiniert werden, was zur Bildung eines Niederschlags (Bariumbromid) und löslichen Kupfer(II)-acetats führt.
F: Wie hoch ist der Schmelzpunkt von Kupferacetat?
A: Der Schmelzpunkt von Kupferacetat liegt bei etwa 115 °C bis 120 °C (239 °F bis 248 °F).
F: Wie stellt man Kupferacetat aus Kupfersulfat her?
A: Um Kupferacetat aus CuSO4 herzustellen, lösen Sie CuSO4 in Wasser und geben Sie dann Essigsäure zur Lösung, bis Kupferacetat ausfällt. Filtern und trocknen Sie das Produkt.
F: Was ist Kupferacetat?
A: Kupferacetat ist eine chemische Verbindung mit der Formel Cu(CH3COO)2. Es ist ein blaugrüner kristalliner Feststoff und hat verschiedene industrielle Anwendungen.
F: Ist Kupferacetat wasserlöslich?
A: Ja, Kupferacetat ist in Wasser mäßig löslich und bildet eine blaugrüne Lösung.
F: Warum ist Kupferacetatlösung trüb?
A: Kupferacetatlösung kann aufgrund von Verunreinigungen oder der Bildung unlöslicher Kupferverbindungen trüb werden, insbesondere wenn die Lösung nicht ordnungsgemäß zubereitet oder gelagert wird.
F: Oxidation von Cu(OAc)2?
A: Kupfer(II)-acetat (Cu(OAc)2) kann bei bestimmten Reaktionen als Oxidationsmittel wirken, wobei es einer Reduktion unterliegt und gleichzeitig andere Substanzen oxidiert.
