Kupfernitrat (Cu(NO3)2) ist eine blaue kristalline Verbindung, die in verschiedenen Industrien verwendet wird. Es dient als Katalysator, Oxidationsmittel und Vorläufer für Kupferwerkstoffe in chemischen Prozessen.
| IUPAC-Name | Kupfer(II)nitrat |
| Molekularformel | Cu(NO3)2 |
| CAS-Nummer | 3251-23-8 |
| Synonyme | Kupfernitrat; Kupfernitrat; Kupfernitrat; Salpetersäure, Kupfersalz (2+) |
| InChI | InChI=1S/2NO3.Cu/c2 2-1(3)4;/q2 -1;+2 |
Eigenschaften von Kupfernitrat
Kupfernitrat-Formel
Die chemische Formel für Kupfernitrat lautet Cu(NO3)2. Dies weist darauf hin, dass jedes Kupfernitratmolekül ein Kupferion (Cu) und zwei Nitrationen (NO3) enthält. Das Vorhandensein von Kupfer(II)-Ionen weist auf eine Oxidationsstufe von Kupfer von +2 hin.
Molmasse von Kupfernitrat
Die Molmasse von Kupfernitrat kann durch Addition der Atommassen seiner Bestandteile berechnet werden. Kupfer (Cu) hat eine Molmasse von etwa 63,55 g/mol, während Nitrat (NO3) eine Molmasse von etwa 62,00 g/mol hat. Die Molmasse von Kupfernitrat beträgt also etwa 187,55 g/mol.
Siedepunkt von Kupfernitrat
Der Siedepunkt von Kupfernitrat bezieht sich auf die Temperatur, bei der es unter normalem Atmosphärendruck von einer Flüssigkeit in einen Gaszustand übergeht. Der Siedepunkt von Kupfernitrat liegt im Allgemeinen über 100 °C (212 °F). Es ist jedoch wichtig zu beachten, dass sich Kupfernitrat im Allgemeinen zersetzt, bevor es seinen Siedepunkt erreicht.
Schmelzpunkt von Kupfernitrat
Der Schmelzpunkt von Kupfernitrat ist die Temperatur, bei der es vom festen in den flüssigen Zustand übergeht. Der Schmelzpunkt von Kupfernitrat liegt im Allgemeinen zwischen 256 °C und 260 °C (493 °F und 500 °F). Es ist wichtig, mit diesem Stoff vorsichtig umzugehen, um eine Zersetzung zu vermeiden.
Dichte von Kupfernitrat g/ml
Die Dichte von Kupfernitrat bezieht sich auf seine Masse pro Volumeneinheit. Die Dichte von festem Kupfernitrat liegt im Allgemeinen bei etwa 2,32 g/ml, während die Dichte seiner wässrigen Lösungen je nach Konzentration variieren kann.
Molekulargewicht von Kupfernitrat
Das Molekulargewicht von Kupfernitrat ist die Summe der Atomgewichte aller Atome in seiner chemischen Formel. Für Cu(NO3)2 beträgt das Molekulargewicht etwa 187,55 g/mol.
Struktur von Kupfernitrat
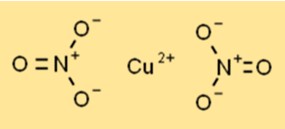
Kupfernitrat liegt als blauer kristalliner Feststoff mit hexagonaler Kristallstruktur vor. Jedes Kupferion (Cu2+) ist von sechs Sauerstoffatomen aus zwei Nitrationen umgeben, wodurch eine koordinierte Anordnung entsteht. Die Struktur trägt zu seiner Stabilität und Reaktivität in verschiedenen chemischen Prozessen bei.
Löslichkeit von Kupfernitrat
Kupfernitrat ist in Wasser mäßig löslich. Wenn es in Wasser gelöst wird, bildet es eine wässrige Lösung, die in verschiedenen Anwendungen wie der Galvanisierung und als Reagens bei chemischen Reaktionen verwendet werden kann. Allerdings nimmt seine Löslichkeit bei niedrigeren Temperaturen ab.
| Aussehen | Blauer kristalliner Feststoff |
| Spezifisches Gewicht | N / A |
| Farbe | Blau |
| Geruch | Geruchlos |
| Molmasse | 187,55 g/Mol |
| Dichte | 2,32 g/ml (fest) |
| Fusionspunkt | 256–260 °C (493–500 °F) |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | N / A |
| Löslichkeit in Wasser | Mäßig löslich, bildet eine wässrige Lösung |
| Löslichkeit | In Wasser löslich |
| Dampfdruck | N / A |
| Wasserdampfdichte | N / A |
| pKa | N / A |
| pH-Wert | Säure |
Sicherheit und Gefahren von Kupfernitrat
Kupfernitrat wirft gewisse Sicherheits- und Gefahrenbedenken auf. Es ist wichtig, mit dieser Verbindung vorsichtig umzugehen. Direkter Kontakt mit der Haut oder den Augen kann zu Reizungen oder Verbrennungen führen. Das Einatmen von Staub oder Dämpfen kann zu Reizungen der Atemwege führen. Beim Erhitzen können giftige Stickoxide freigesetzt werden. Der Stoff ist außerdem ein Oxidationsmittel und kann bei Kontakt brennbare Materialien entzünden. Bei der Arbeit mit Kupfernitrat sollte geeignete Schutzausrüstung wie Handschuhe und Schutzbrille getragen werden. Um potenzielle Risiken zu minimieren, sollte es fern von brennbaren Materialien und unverträglichen Substanzen gelagert werden. Befolgen Sie immer die Sicherheitshinweise und verwenden Sie es in einem gut belüfteten Bereich.
| Gefahrensymbole | Oxidationsmittel, Ätzend, Reizend |
| Sicherheitsbeschreibung | Mit Anzahlung umgehen. Kontakt mit Haut und Augen vermeiden. In einem gut belüfteten Bereich verwenden. Von brennbaren Materialien fernhalten. |
| UN-Identifikationsnummern | UN3085 |
| HS-Code | 28342910 |
| Gefahrenklasse | 5.1 (Oxidationsmittel) |
| Verpackungsgruppe | III |
| Toxizität | Gesundheitsschädlich beim Verschlucken. Kann Haut- und Augenreizungen verursachen. Das Einatmen von Staub oder Dämpfen kann zu Reizungen der Atemwege führen. |
Methoden zur Kupfernitrat-Synthese
Es gibt verschiedene Methoden zur Synthese von Kupfernitrat.
Ein gängiger Ansatz beinhaltet die Reaktion zwischen Kupferoxid (CuO) oder Kupferhydroxid (Cu(OH)2) mit Salpetersäure (HNO3) . Bei der Herstellung von Kupfernitrat kann man langsam Kupferoxid oder Kupferhydroxid zu einer Salpetersäurelösung hinzufügen, was zur Bildung von Kupfernitrat und Wasser führt.
Eine andere Methode beinhaltet die Reaktion zwischen metallischem Kupfer (Cu) und konzentrierter Salpetersäure. Das Metall Cu reagiert mit Salpetersäure unter Bildung von Kupfernitrat, Stickstoffdioxid (NO2) und Wasser. Aufgrund der Bildung von giftigem Stickstoffdioxid erfordert diese Methode eine sorgfältige Handhabung.
Alternativ können Sie metallisches Kupfer oder Kupferoxid in einer Mischung aus Salpetersäure und Wasserstoffperoxid (H2O2) auflösen, um Kupfernitrat herzustellen. Diese Methode ermöglicht eine schnellere Reaktion und erzeugt reines Kupfernitrat.
Schließlich kann durch die doppelte Verdrängungsreaktion zwischen CuSO4 und Natriumnitrat (NaNO3) auch Kupfernitrat entstehen. Durch Mischen dieser beiden Salze in Wasser fällt das Kupfernitrat aus und das Nebenprodukt Natriumsulfat bleibt gelöst.
Befolgen Sie während der Synthese Sicherheitsvorkehrungen, da die beteiligten Chemikalien reaktiv sind. Verwenden Sie geeignete Schutzausrüstung und wenden Sie geeignete Laborpraktiken an, um eine erfolgreiche und sichere Synthese von Kupfernitrat zu gewährleisten.
Verwendung von Kupfernitrat
Kupfernitrat findet aufgrund seiner einzigartigen Eigenschaften vielfältige Anwendungen in verschiedenen Branchen. Einige bemerkenswerte Verwendungszwecke sind:
- Katalysator: Es fungiert als Katalysator in der organischen Synthese und erleichtert Reaktionen wie die Umwandlung von Alkoholen in Aldehyde oder Ketone.
- Pyrotechnik: Kupfernitrat ist ein wichtiger Bestandteil pyrotechnischer Formulierungen und trägt zur blauen und grünen Farbe der Flammen bei.
- Landwirtschaft: In der Landwirtschaft dient es als Kupferquelle in Düngemitteln, um Pflanzen mit wichtigen Nährstoffen zu versorgen.
- Oxidationsmittel: Kupfernitrat oxidiert bei chemischen Prozessen aktiv andere Stoffe.
- Metallbeschichtung: Kupfernitrat scheidet während Galvanisierungsprozessen aktiv eine dünne Cu-Schicht auf verschiedenen Metalloberflächen ab.
- Pigmente und Farbstoffe: Kupfernitrat trägt aktiv zur Bildung grüner und blauer Pigmente für Keramik, Glas und Textilien bei.
- Fotografische Prozesse: Kupfernitrat trägt aktiv zur Bildentwicklung in bestimmten fotografischen Lösungen bei.
- Konservierung: Es findet Anwendung bei der Holzkonservierung, indem es bei der Fixierung von Konservierungsmitteln hilft.
- Herstellung anderer Kupferverbindungen: Es dient als Vorstufe für die Synthese verschiedener Materialien und Verbindungen auf Kupferbasis.
Die Vielseitigkeit und Reaktivität von Kupfernitrat machen es zu einer wertvollen Chemikalie in einer Vielzahl von Bereichen, von industriellen Prozessen bis hin zu künstlerischen Anwendungen.
Fragen:
F: Was passiert, wenn Kupfernitrat erhitzt wird?
A: Beim Erhitzen zerfällt Kupfernitrat in Kupferoxid, Stickstoffdioxidgas und Sauerstoff.
F: Ist Kupfernitrat wasserlöslich?
A: Ja, Kupfernitrat ist in Wasser mäßig löslich.
F: Wie lautet die chemische Formel von Kupfernitrat?
A: Die chemische Formel für Kupfernitrat lautet Cu(NO3)2.
F: Ist Kupfernitrat ein starker Elektrolyt?
A: Ja, Kupfernitrat ist ein starker Elektrolyt, der beim Auflösen in Wasser in Ionen zerfällt.
F: Wie hoch ist die Ladung von Kupfernitrat?
A: Kupfernitrat hat eine Nettoladung von 0; es ist eine neutrale Verbindung.
F: Wie viele Stickstoffatome sind in 10,2 g Kupfer(II)-nitrat enthalten?
A: Es gibt ungefähr 0,161 Mol Kupfer(II)-nitrat und daher ungefähr 0,322 Mol Stickstoffatome.
F: Wie viel Silber kann aus 3,00 Mol Kupfer und 3,85 Mol Silbernitrat hergestellt werden?
A: Nach der ausgewogenen chemischen Gleichung können 342,3 g Silber hergestellt werden.
F: Ist Kupfernitrat löslich?
A: Ja, Kupfernitrat ist wasserlöslich.
F: Wie lautet die Formel für Kupfer(II)-nitrat?
A: Die Formel für Kupfer(II)-nitrat lautet Cu(NO3)2.
F: Was bewirkt die Austauschreaktion von Cu(NO3)2 und Zn?
A: Bei der Austauschreaktion entstehen Zinknitrat (Zn(NO3)2) und Kupfermetall (Cu).
F: Was ist Cu(NO3)2?
A: Cu(NO3)2 ist die chemische Formel für Kupfernitrat, eine blaue kristalline Verbindung.
F: Welcher der folgenden Stoffe wird in der folgenden Reaktion reduziert? Cu(NO3)2 + Zn -> Zn(NO3)2 + Cu
A: Kupfer (Cu) wird während der Reaktion reduziert und nimmt Elektronen auf, um metallisches Kupfer zu bilden.
F: Bildet sich ein festes Cu(OH)2, wenn 0,075 g KOH in 1,0 l Cu(NO3)2 1,0 × 10⁻³ M gelöst werden?
A: Nein, festes Cu(OH)2 bildet sich nicht, da Cu(NO3)2 in Lösung vollständig ionisiert und es einen Überschuss an OH⁻-Ionen aus KOH gibt.
