Lithiumbicarbonat (LiHCO3) ist eine chemische Verbindung, die in verschiedenen Anwendungen eingesetzt wird. Es hat alkalische Eigenschaften und wird in der Forschung, in Arzneimitteln und als potenzielle Behandlung für bestimmte Erkrankungen eingesetzt.
| IUPAC-Name | Lithiumbicarbonat |
| Molekularformel | LiHCO3 |
| CAS-Nummer | 5006-97-3 |
| Synonyme | Lithiumhydrogencarbonat, Li-Bicarbonat |
| InChI | InChI=1S/CH2O3.Li/c2-1(3)4;/h(H2,2,3,4);/q;+1 |
Eigenschaften von Lithiumbicarbonat
Lithiumbicarbonat-Formel
Lithiumhydrogencarbonat hat die chemische Formel LiHCO3. Es besteht aus einem Lithium-Kation (Li), einem Hydrogencarbonat-Anion (HCO3) und einem Wasserstoffatom (H). Die Formel spiegelt das Vorhandensein von Lithium- und Bicarbonationen in der Verbindung wider.
Molmasse von Lithiumbicarbonat
Die Molmasse von Lithiumhydrogencarbonat (LiHCO3) beträgt etwa 68 Gramm pro Mol (g/mol). Sie wird durch Addition der Atommassen seiner Bestandteile berechnet: Lithium, Wasserstoff, Kohlenstoff und Sauerstoff.
Siedepunkt von Lithiumbicarbonat
Lithiumhydrogencarbonat hat keinen genau definierten Siedepunkt, da es sich bei hohen Temperaturen zersetzt. Beim Erhitzen verliert es Kohlendioxid (CO2) und Wasser (H2O) und wandelt sich in Lithiumcarbonat (Li2CO3) um.
Schmelzpunkt von Lithiumbicarbonat
Lithiumhydrogencarbonat hat einen Schmelzpunkt von etwa 250 Grad Celsius (482 Grad Fahrenheit). Bei dieser Temperatur vollzieht es einen Phasenübergang vom festen in den flüssigen Zustand.
Dichte von Lithiumbicarbonat g/ml
Die Dichte von Lithiumhydrogencarbonat (LiHCO3) beträgt etwa 2,21 Gramm pro Milliliter (g/ml). Aufgrund des Vorhandenseins von Lithium und anderen schweren Elementen ist es eine relativ dichte Verbindung.
Molekulargewicht von Lithiumbicarbonat
Lithiumhydrogencarbonat hat ein Molekulargewicht von etwa 68 g/mol. Das Molekulargewicht stellt die Summe der Atomgewichte aller Atome in einem einzelnen Molekül der Verbindung dar.
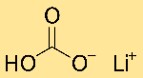
Struktur von Lithiumbicarbonat
Lithiumhydrogencarbonat hat eine kristalline Struktur. Es bildet ein Netzwerk aus Lithium-, Hydrogencarbonat- und Wasserstoffatomen, die in einem sich wiederholenden Muster angeordnet sind. Die Struktur wird durch ionische und kovalente Bindungen zusammengehalten.
Löslichkeit von Lithiumbicarbonat
Lithiumhydrogencarbonat ist in Wasser schlecht löslich. Es löst sich zu einem gewissen Grad in Wasser und ergibt eine leicht alkalische Lösung. Allerdings ist seine Löslichkeit im Vergleich zu anderen Lithiumverbindungen relativ gering.
| Aussehen | weißes kristallines Pulver |
| Spezifisches Gewicht | ~2,21 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | ~68 g/Mol |
| Dichte | ~2,21 g/ml |
| Fusionspunkt | ~250°C (482°F) |
| Siedepunkt | Zersetzt |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Leicht löslich, ergibt eine leicht alkalische Lösung |
| Löslichkeit | Grenze |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Leicht alkalisch |
Sicherheit und Gefahren von Lithiumbicarbonat
Lithiumhydrogencarbonat weist bestimmte Sicherheitsaspekte und Gefahren auf. Es ist wichtig, vorsichtig mit der Verbindung umzugehen, um Risiken zu minimieren. Direkter Kontakt mit der Haut oder den Augen kann zu Reizungen führen. Das Einatmen von Staub oder Dämpfen sollte vermieden werden, da dies zu Atembeschwerden führen kann. Beim Erhitzen zersetzt es sich und setzt Kohlendioxid und Wasserdampf frei, was in geschlossenen Räumen potenziell gefährlich sein kann. Darüber hinaus ist es wichtig, Lithiumhydrogencarbonat ordnungsgemäß und fern von inkompatiblen Substanzen zu lagern. Bei der Arbeit mit dieser Verbindung sollten ausreichende Belüftung und persönliche Schutzausrüstung verwendet werden, um eine sichere Umgebung zu gewährleisten.
| Gefahrensymbole | Nicht verfügbar |
| Sicherheitsbeschreibung | Mit Vorsicht behandeln. Einatmen sowie Haut- und Augenkontakt vermeiden. Richtig lagern. In gut belüfteten Bereichen verwenden. |
| UN-Identifikationsnummern | Nicht verfügbar |
| HS-Code | Nicht verfügbar |
| Gefahrenklasse | Nicht verfügbar |
| Verpackungsgruppe | Nicht verfügbar |
| Toxizität | Geringe Toxizität; mit Anzahlung abwickeln. |
Methoden zur Synthese von Lithiumbicarbonat
Verschiedene Methoden ermöglichen die Synthese von Lithiumhydrogencarbonat.
Ein gängiger Ansatz ist die Reaktion von Lithiumhydroxid (LiOH) mit Kohlendioxid (CO2). Die Reaktion findet in einer wässrigen Lösung statt, wobei Lithiumhydroxid in Lithium- und Hydroxidionen zerfällt. Gleichzeitig löst sich Kohlendioxid in Wasser und bildet Kohlensäure (H2CO3) . Anschließend reagieren die Lithiumionen mit Kohlensäure zu Lithiumhydrogencarbonat (LiHCO3) und Wasser (H2O). Die chemische Gleichung für diese Reaktion lautet:
LiOH + CO2 → LiHCO3 + H2O
Eine andere Methode besteht darin , Lithiumcarbonat (Li2CO3) mit Kohlendioxid in einem geschlossenen System zu behandeln, wodurch Lithiumbicarbonat entsteht. Die chemische Gleichung für diese Reaktion lautet:
Li2CO3 + CO2 → 2LiHCO3
Diese Synthesemethoden sind wichtig für die Herstellung von Lithiumhydrogencarbonat im Labor und für industrielle Anwendungen. Es ist von entscheidender Bedeutung, Sicherheitsprotokolle zu befolgen und während des Syntheseprozesses für die richtige Ausrüstung und Bedingungen zu sorgen.
Verwendungsmöglichkeiten von Lithiumbicarbonat
Aufgrund seiner einzigartigen Eigenschaften findet Lithiumhydrogencarbonat zahlreiche Anwendungen. Hier sind einige seiner Hauptanwendungen:
- Forschung und Labor: Es dient als wertvolles Reagenz in verschiedenen chemischen und Forschungsexperimenten und ermöglicht es Wissenschaftlern, chemische Reaktionen und Eigenschaften zu untersuchen.
- Potenzielle medizinische Behandlung: Derzeit laufen Studien zu seiner möglichen Rolle bei der Behandlung von Krankheiten wie Lithiummangel und bestimmten Nierenerkrankungen sowie als Alkalisierungsmittel.
- Umweltanwendungen: Es kann zur Entfernung von Kohlendioxid aus industriellen Prozessen beitragen und hat potenzielle Anwendungen bei der Minderung von Treibhausgasemissionen.
- Alkalisierungsmittel: In bestimmten industriellen Prozessen fungiert es als Alkalisierungsmittel, um den Säuregehalt zu kontrollieren und den pH-Wert zu regulieren.
- Pharmazeutische Industrie: Pharmazeutische Formulierungen verwenden Lithiumhydrogencarbonat hauptsächlich in Medikamenten gegen Stimmungsstörungen wie bipolare Störungen.
- Herstellung von Lithiumbatterien: Forscher und experimentelle Kreise erforschen die Verwendung von Lithiumhydrogencarbonat in fortschrittlichen Lithiumbatterien, um die Batterieleistung zu verbessern.
- Wasseraufbereitung: Wasseraufbereitungsprozesse nutzen Lithiumbicarbonat, um den pH-Wert von Wasserquellen anzupassen.
- Landwirtschaft: Lithiumhydrogencarbonat findet in der Landwirtschaft nur begrenzte Verwendung, wo Landwirte es zur Behandlung spezifischer Bodenbedingungen und zur Verbesserung des Pflanzenwachstums einsetzen.
Trotz dieser Anwendungen ist es angesichts der potenziellen Gefahren und Reaktivität von entscheidender Bedeutung, sorgfältig mit Lithiumhydrogencarbonat umzugehen und Sicherheitsvorkehrungen zu befolgen. Mit fortschreitender Forschung und technologischen Fortschritten könnten neue Verwendungsmöglichkeiten für Lithiumhydrogencarbonat entstehen, die seine Bedeutung in verschiedenen Bereichen weiter steigern würden.
Fragen:
F: Wie lautet die chemische Formel von Lithiumbicarbonat?
A: Die chemische Formel von Lithiumhydrogencarbonat lautet LiHCO3.
F: Kann Lithiumbicarbonat einen Vitamin-D-Mangel verursachen?
A: Es gibt keine Hinweise darauf, dass Lithiumhydrogencarbonat einen niedrigen Vitamin-D-Spiegel verursacht.
F: Was funktioniert besser: Lithiumcarbonat oder Lithiumbicarbonat?
A: Die Wirksamkeit von Lithiumcarbonat oder Lithiumbicarbonat hängt von der jeweiligen Anwendung und dem Verwendungszweck ab.
F: Interagiert Lithiumbicarbonat mit Baldrianextrakt?
A: Es sind keine Wechselwirkungen zwischen Lithiumhydrogencarbonat und Baldrianextrakt bekannt, die Konsultation eines Arztes ist jedoch unbedingt erforderlich.
F: Was ist Lithiumbicarbonat?
A: Lithiumhydrogencarbonat ist eine chemische Verbindung mit alkalischen Eigenschaften, die in einer Vielzahl von Anwendungen einschließlich Forschung und Pharmazie eingesetzt wird.
F: Können Lithiumbicarbonat und Lithiumcarbonat in Wasser erhitzt werden?
A: Lithiumhydrogencarbonat und Lithiumcarbonat können in Wasser erhitzt werden, sie zerfallen jedoch und bilden andere Verbindungen.
F: Wie hoch ist der Gewichtsverlust, wenn 3,45 g LiHCO3 abgebaut werden?
A: Der Gewichtsverlust bei der Zersetzung von 3,45 g LiHCO3 hängt von der spezifischen Reaktion und den gebildeten Produkten ab.
F: Ist LiHCO3 ein starker Elektrolyt?
A: Nein, Lithiumhydrogencarbonat (LiHCO3) ist ein schwacher Elektrolyt.
F: Welches Salz würde durch die Reaktion von H2SO4 mit LiHCO3 entstehen?
A: Bei der Reaktion zwischen H2SO4 und LiHCO3 entstehen Lithiumsulfat (Li2SO4), Kohlendioxid (CO2) und Wasser (H2O).
F: Ist LiHCO3 eine Säure oder eine Base?
A: Lithiumhydrogencarbonat (LiHCO3) fungiert aufgrund seiner alkalischen Eigenschaften als Base.
F: Reagiert N-Methylethanamin mit LiHCO3?
A: Die Reaktivität von N-Methylethanamin mit LiHCO3 hängt von den spezifischen Reaktionsbedingungen und den gewünschten Produkten ab.
