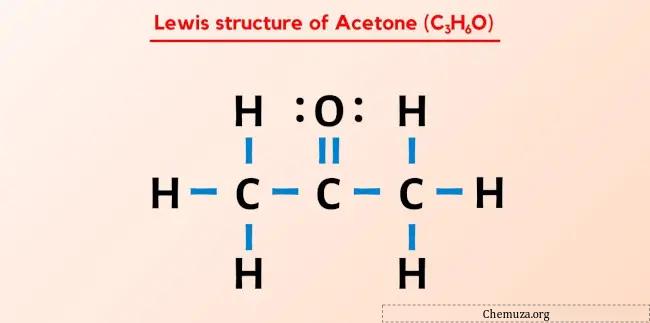
Die Lewis-Struktur von Aceton (auch bekannt als Propanon oder C3H6O) besteht aus drei aufeinanderfolgenden Kohlenstoffatomen (C), an die ein Sauerstoffatom (O) doppelt an das zentrale Kohlenstoffatom (C) gebunden ist und drei einzelne Wasserstoffatome (H) gebunden sind zu jedem äußeren Kohlenstoffatom (C). Am Sauerstoffatom (O) gibt es zwei freie Elektronenpaare.
Lassen Sie uns in einfachen Schritten die Lewis-Struktur von Aceton verstehen.
Schritte zum Zeichnen der Lewis-Struktur von Aceton (C3H6O)
Schritt 1: Ermitteln Sie die Gesamtzahl der Valenzelektronen im C3H6O-Molekül
Um die Gesamtzahl der Valenzelektronen in einem C3H6O- Molekül zu ermitteln, müssen Sie zunächst die im Kohlenstoffatom , Wasserstoffatom und Sauerstoffatom vorhandenen Valenzelektronen kennen.
(Valenzelektronen sind die Elektronen, die sich in der äußersten Umlaufbahn eines Atoms befinden.)
Hier erkläre ich Ihnen, wie Sie mithilfe eines Periodensystems ganz einfach die Valenzelektronen von Kohlenstoff, Wasserstoff und Sauerstoff finden.
Gesamtvalenzelektronen im C3H6O-Molekül
→ Vom Kohlenstoffatom gegebene Valenzelektronen:
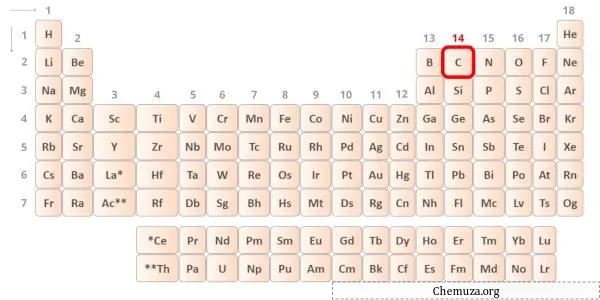
Kohlenstoff ist ein Element der Gruppe 14 des Periodensystems. [1] Daher sind im Kohlenstoff 4 Valenzelektronen vorhanden.
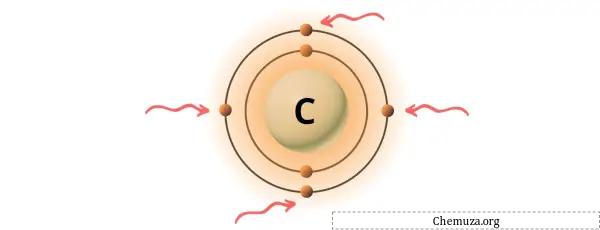
Sie können die 4 im Kohlenstoffatom vorhandenen Valenzelektronen sehen, wie im Bild oben gezeigt.
→ Vom Wasserstoffatom gegebene Valenzelektronen:
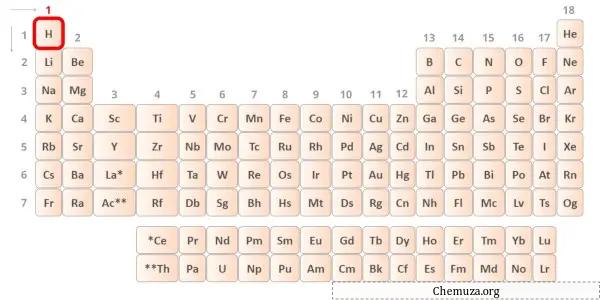
Wasserstoff ist ein Element der Gruppe 1 des Periodensystems.[2] Daher beträgt das im Wasserstoff vorhandene Valenzelektron 1 .

Sie können sehen, dass im Wasserstoffatom nur ein Valenzelektron vorhanden ist, wie im Bild oben gezeigt.
→ Vom Sauerstoffatom gegebene Valenzelektronen:

Sauerstoff ist ein Element der 16. Gruppe des Periodensystems. [3] Daher sind im Sauerstoff 6 Valenzelektronen vorhanden.
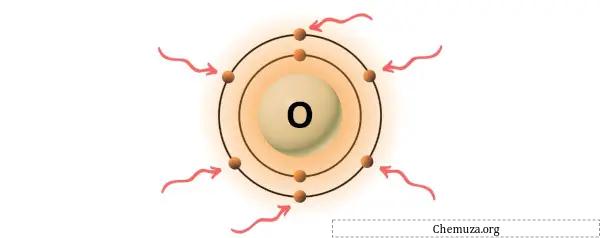
Sie können die 6 im Sauerstoffatom vorhandenen Valenzelektronen sehen, wie im Bild oben gezeigt.
Also,
Gesamte Valenzelektronen im C3H6O-Molekül = von 3 Kohlenstoffatomen gespendete Valenzelektronen + von 6 Wasserstoffatomen gespendete Valenzelektronen + von 1 Sauerstoffatom gespendete Valenzelektronen = 4(3) + 1(6) + 6 = 24 .
Schritt 2: Bereiten Sie die Skizze vor
Die Lewis-Struktur von Aceton besteht aus drei aufeinanderfolgenden Kohlenstoffatomen, wobei an das zentrale Kohlenstoffatom ein Sauerstoffatom gebunden ist. Die Wasserstoffatome sind an die beiden äußeren Kohlenstoffatome gebunden. Das Sauerstoffatom ist doppelt an das Kohlenstoffatom gebunden, während die Wasserstoffatome einfach an die Kohlenstoffatome gebunden sind.
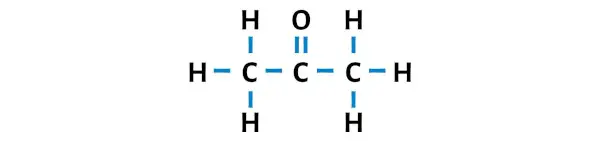
Schritt 3: Machen Sie die externen Atome stabil
Hier in der Skizze des C3H6O-Moleküls können Sie sehen, dass die äußeren Atome Wasserstoffatome und Sauerstoffatome sind.
Wasserstoffatome sind stabil, weil sie zwei Elektronen haben (weil Wasserstoff nur zwei Elektronen benötigt, um ein stabiles Dublett zu bilden).
Machen wir nun das Sauerstoffatom stabil, indem wir darauf ein Oktett bilden.
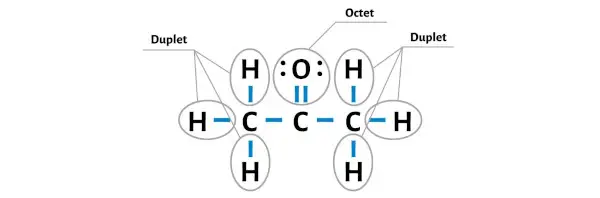
Sie können jetzt sehen, dass alle äußeren Atome stabil sind.
Zusätzlich haben wir in Schritt 1 die Gesamtzahl der im C3H6O-Molekül vorhandenen Valenzelektronen berechnet.
Das C3H6O-Molekül verfügt über insgesamt 24 Valenzelektronen und alle diese Valenzelektronen werden im obigen Diagramm von C3H6O verwendet.
Daher ist die obige Lewis-Struktur von C3H6O (oder Aceton) eine stabile Struktur.
Ich hoffe, Sie haben die oben genannten Schritte verstanden.
Für mehr Übung und ein besseres Verständnis können Sie andere unten aufgeführte Lewis-Strukturen ausprobieren.
Probieren Sie zum besseren Verständnis diese Lewis-Strukturen aus (oder sehen Sie sie sich zumindest an):
