Bleiacetat (Pb(OAc)₂) ist eine weiße kristalline Verbindung. Aufgrund seiner Fähigkeit, das Haar dunkler zu machen, wird es in Haarfärbemitteln verwendet. Es birgt jedoch gesundheitliche Risiken und sollte mit Vorsicht gehandhabt werden.
| IUPAC-Name | Blei(II)-acetat |
| Molekularformel | Pb(OAc)₂ |
| CAS-Nummer | 301-04-2 |
| Synonyme | Blei(II)-ethanolat, Bleiacetat, Bleidiacetat |
| InChI | InChI=1S/2C2H4O2.Pb/c2 1-2(3)4;/h2 1H3,(H,3,4);/q;;+2/p-2 |
Eigenschaften von Bleiacetat
Bleiacetat-Formel
Die chemische Formel für Bleidiacetat lautet Pb(OAc)₂, wobei Pb das Symbol für Blei darstellt und OAc das Ion CH₃COO⁻ bezeichnet. Es handelt sich um eine weiße kristalline Verbindung mit zwei CH₃COO⁻-Ionen pro Bleiatom.
Molmasse von Bleiacetat
Bleidiacetat hat eine Molmasse von etwa 325,29 g/mol. Um dies zu berechnen, addieren wir die Atommassen eines Pb-Atoms und zweier CH₃COO⁻-Ionen, die in seiner chemischen Formel enthalten sind.
Siedepunkt von Bleiacetat
Der Siedepunkt von Bleidiacetat liegt bei etwa 280 °C (536 °F). Wenn es hohen Temperaturen ausgesetzt wird, vollzieht es einen Phasenübergang von fest zu flüssig, sodass Vorsicht beim Umgang damit geboten ist.
Schmelzpunkt von Bleiacetat
Bleidiacetat hat einen Schmelzpunkt von etwa 280 °C (536 °F). Bei dieser Temperatur verwandelt sich die feste Verbindung in eine Flüssigkeit, wodurch sie für bestimmte Anwendungen wie Haarfärbemittel geeignet ist.
Dichte von Bleiacetat g/ml
Die Dichte von Bleidiacetat beträgt etwa 3,25 g/ml. Dieser Wert stellt die Masse der Verbindung pro Volumeneinheit dar und ist wichtig für das Verständnis ihrer physikalischen Eigenschaften und Anwendungen.
Molekulargewicht von Bleiacetat
Das Molekulargewicht von Bleidiacetat beträgt etwa 325,29 g/mol. Es liefert wichtige Informationen für verschiedene chemische Berechnungen und hilft Forschern, sein Verhalten und seine Reaktivität zu verstehen.
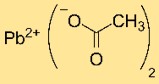
Struktur aus Bleiacetat
Bleidiacetat hat eine Kristallstruktur mit Pb²⁺-Kationen, die an zwei CH₃COO⁻-Ionen koordiniert sind. Die Anordnung der Atome und Bindungen im Kristallgitter bestimmt dessen Stabilität und Eigenschaften.
Löslichkeit von Bleiacetat
Bleidiacetat ist in Wasser schlecht löslich. Es löst sich teilweise auf und bildet eine klare, farblose Lösung. Seine Löslichkeit variiert mit der Temperatur, weshalb seine Lagerung und ordnungsgemäße Handhabung entscheidend sind, um eine Kontamination der Umwelt zu vermeiden.
| Aussehen | Weiß kristallin |
| Spezifisches Gewicht | ~3,25 g/ml |
| Farbe | Farblos |
| Geruch | Geruchlos |
| Molmasse | ~325,29 g/Mol |
| Dichte | ~3,25 g/ml |
| Fusionspunkt | ~280°C (536°F) |
| Siedepunkt | ~280°C (536°F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit | Begrenzte Löslichkeit, variiert je nach Temperatur |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Nicht verfügbar |
| pH-Wert | Nicht verfügbar |
Sicherheit und Gefahren von Bleiacetat
Bleidiacetat birgt erhebliche Sicherheitsrisiken und sollte mit großer Vorsicht gehandhabt werden. Es ist giftig, wenn es verschluckt, eingeatmet oder über die Haut aufgenommen wird. Eine längere Exposition kann zu einer Bleivergiftung führen, die sich negativ auf die Gesundheit, einschließlich des Nervensystems und der Nieren, auswirkt. Kontakt mit Augen, Haut und Kleidung vermeiden. Sorgen Sie bei der Handhabung für ausreichende Belüftung und persönliche Schutzausrüstung. Verhindern Sie, dass es in die Umwelt gelangt, da es Boden und Wasser verunreinigen und sich auf die Ökosysteme auswirken kann. Bewahren Sie es außerhalb der Reichweite von Kindern und Tieren auf. Entsorgen Sie es ordnungsgemäß gemäß den örtlichen Vorschriften. Insgesamt ist die strikte Einhaltung der Sicherheitsrichtlinien entscheidend für die Minimierung von Risiken.
| Gefahrensymbole | Gesundheitsrisiko, Umweltrisiko |
| Sicherheitsbeschreibung | Giftig und schädlich für die Umwelt |
| UN-Identifikationsnummern | UN1616 |
| HS-Code | 29152900 |
| Gefahrenklasse | 6.1 (Giftige Stoffe) |
| Verpackungsgruppe | II |
| Toxizität | Sehr giftig |
Methoden zur Synthese von Bleiacetat
Es gibt verschiedene Methoden zur Synthese von Bleidiacetat.
Ein gängiger Ansatz ist die Reaktion von metallischem Blei mit Essigsäure . Bei dieser Methode geben Sie normalerweise Blei in einen Behälter und gießen langsam Essigsäure in den Behälter, während Sie die Bedingungen wie Rühren und Temperaturregulierung kontrollieren. Die Reaktion schreitet voran und bildet Bleidiacetat als weißen Niederschlag.
Eine andere Methode beinhaltet die Reaktion von Bleioxid (PbO) oder Bleicarbonat (PbCO₃) mit Eisessig. Sie mischen Bleioxid oder Bleicarbonat mit Essigsäure und erhitzen die Mischung, was zu einer Reaktion führt, die zu Bleidiacetat führt.
Ein weiterer Syntheseweg besteht darin, die doppelte Verdrängungsreaktion von Pb(NO₃)₂ mit CH3COONa in einer wässrigen Lösung durchzuführen. Bei dieser Reaktion entsteht Bleidiacetat als Niederschlag.
Aufgrund der Toxizität von Bleiverbindungen ist bei diesen Synthesemethoden Vorsicht geboten. Sie müssen entsprechende Sicherheitsmaßnahmen befolgen und Prozesse in gut belüfteten Bereichen mit geeigneter Schutzausrüstung durchführen. Darüber hinaus ist die Einhaltung der Abfallentsorgungsvorschriften von entscheidender Bedeutung, um eine Umweltverschmutzung zu verhindern.
Verwendung von Bleiacetat
Aufgrund seiner einzigartigen Eigenschaften findet Bleidiacetat vielfältige Anwendungen. Hier sind einige Verwendungsmöglichkeiten:
- Haarfärbemittel : Einige Haarfärbemittel verwenden Bleidiacetat, um das Haar mit der Zeit allmählich dunkler zu machen. Aufgrund seiner Toxizität ist seine Verwendung in Kosmetikprodukten jedoch in vielen Ländern eingeschränkt.
- Laborreagenz : Es wird als Reagenz in Labors für verschiedene chemische Reaktionen und Analysen verwendet.
- Fotografie: Früher verwendeten Fotografen Bleidiacetat zur Sensibilisierung von Fotofilmen und -papieren beim Fotografieren in Schwarzweiß.
- Bleizucker: In der Vergangenheit verwendeten die Menschen Bleidiacetat, bekannt als „Bleizucker“, zur Konservierung von Wein und anderen Getränken.
- Analytische Chemie: In der analytischen Chemie verwenden Wissenschaftler Bleidiacetat, um das Vorhandensein von Schwefelwasserstoffgas nachzuweisen.
- Beizmittel beim Färben : Es dient als Beizmittel beim Färben und Bedrucken von Textilien.
- Chemische Synthese : Es dient als Vorstufe für die Synthese anderer Bleiverbindungen.
Trotz seiner vielfältigen Einsatzmöglichkeiten ist bei Bleidiacetat aufgrund seiner hohen Toxizität Vorsicht geboten. Minimieren Sie die Exposition gegenüber Bleiverbindungen und befolgen Sie bei der Handhabung und Entsorgung strikt die entsprechenden Sicherheitsvorkehrungen, um die menschliche Gesundheit und die Umwelt zu schützen. Schränken Sie viele seiner Apps ein oder ersetzen Sie sie durch sicherere Alternativen.
Fragen:
F: Ist Blei-II-Acetat wasserlöslich?
A: Blei-II-Diacetat ist in Wasser schlecht löslich.
F: Ist Bleiacetat löslich?
A: Bleidiacetat ist in Wasser schlecht löslich.
F: Welche Haarfärbemittel enthalten Bleiacetat?
A: In einigen Ländern enthalten einige fortschrittliche Haarfärbemittel Bleidiacetat als Inhaltsstoff, dessen Verwendung jedoch aufgrund von Toxizitätsbedenken eingeschränkt ist.
F: Welche Probleme kann eine chronische Exposition gegenüber Essigsäure verursachen?
A: Eine chronische Exposition gegenüber Essigsäure kann zu Reizungen der Atemwege und der Haut führen.
F: Wie lautet die Formel für Blei-II-Diacetat?
A: Die Formel für Blei-II-Diacetat lautet Pb(OAc)₂.
F: Welches Bleiacetat wird im Lindlar-Katalysator verwendet?
A: Blei(II)-diacetat wird im Lindlar-Katalysator im Allgemeinen nicht verwendet; Stattdessen wird Palladiumacetat verwendet.
F: Was ist Bleiacetat?
A: Bleidiacetat ist eine weiße kristalline Verbindung, die in verschiedenen Anwendungen wie Haarfärbemitteln und chemischen Synthesen verwendet wird.
F: Wie stellt man Bleiacetat her?
A: Bleidiacetat kann durch Reaktion von metallischem Blei mit Essigsäure oder durch andere chemische Synthesemethoden hergestellt werden.
F: Gibt es Haarfärbemittel ohne Bleiacetat?
A: Ja, viele moderne Haarfärbemittel enthalten kein Bleidiacetat, da dessen Verwendung in Kosmetikprodukten aufgrund seiner Toxizität in vielen Ländern eingeschränkt ist.
F: Kommt es zu einer Reaktion, wenn wässrige Lösungen von Aluminiumiodid und Blei(II)-acetat kombiniert werden?
A: Ja, es kommt zu einer Reaktion und es entstehen PbI2 und Aluminiumacetat als Produkte.
F: Reagieren Natriumchromat und Blei(II)-acetat?
A: Ja, es findet eine Reaktion statt, die zur Bildung von PbCrO4 und Natriumacetat führt.
F: Welche Chemikalie reagiert mit Kupfer(II)-sulfat zu Blau und mit Blei(II)-Acetat zu Weiß?
A: Ammoniumhydroxid reagiert mit Kupfer(II)sulfat unter Bildung blauer Niederschläge (Kupferhydroxid). Im Gegensatz dazu reagiert Schwefelwasserstoff mit Blei(II)-diacetat zu weißem Bleisulfid.
