Lithiumoxid (Li2O) ist eine Verbindung aus Lithium und Sauerstoff. Es weist starke ionische Eigenschaften auf und wird aufgrund seines hohen elektrochemischen Potenzials häufig in Batterien verwendet.
| IUPAC-Name | Lithiumoxid |
| Molekularformel | Li2O |
| CAS-Nummer | 12142-77-7 |
| Synonyme | Lithium(I)-oxid; Dilithiumoxid; Lithium; Oxolithium; UNII-06T3K8P3KU |
| InChI | InChI=1S/2Li.O |
Lithiumoxid-Formel
Lithiumoxid-Formel
Die chemische Formel für Dilithiumoxid lautet Li2O. Es stellt die Kombination aus zwei Lithiumatomen (Li) und einem Sauerstoffatom (O) dar. Diese einfache und stabile Verbindung ist in verschiedenen industriellen Anwendungen unverzichtbar.
Molmasse von Lithiumoxid
Die Molmasse von Li2O beträgt etwa 29,88 g/mol. Sie wird durch Addition der Atommassen von zwei Lithiumatomen (jeweils 6,94 g/mol) und einem Sauerstoffatom (16,00 g/mol) berechnet.
Siedepunkt von Lithiumoxid
Dilithiumoxid hat einen beeindruckenden Siedepunkt von etwa 2.463 Grad Celsius (4.465 Grad Fahrenheit). Aufgrund seines außergewöhnlich hohen Siedepunkts eignet es sich für Branchen, die eine extreme Hitzebeständigkeit erfordern.
Schmelzpunkt von Lithiumoxid
Der Schmelzpunkt von Dilithiumoxid liegt bei etwa 1.450 Grad Celsius (2.642 Grad Fahrenheit). Bei dieser Temperatur geht es vom festen in den flüssigen Zustand über, was verschiedene Herstellungsprozesse erleichtert.
Dichte von Lithiumoxid g/ml
Dilithiumoxid hat eine Dichte von etwa 2,01 g/ml. Dieser Wert stellt die Masse der Verbindung pro Volumeneinheit dar und ist für die Bestimmung ihrer Eigenschaften und Anwendungen von wesentlicher Bedeutung.
Molekulargewicht von Lithiumoxid
Das Molekulargewicht von Li2O beträgt 29,88 g/mol. Es ist die Summe der Atomgewichte seiner Bestandteile Lithium und Sauerstoff. Dieser Wert erleichtert stöchiometrische Berechnungen.
Struktur von Lithiumoxid
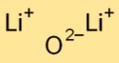
Dilithiumoxid hat eine einfache ionische Kristallstruktur. Es besteht aus Lithiumkationen (Li+) und Oxidanionen (O2-), die durch starke elektrostatische Kräfte zusammengehalten werden. Diese Anordnung trägt zu seiner Stabilität und Leitfähigkeit bei.
Löslichkeit von Lithiumoxid
Dilithiumoxid weist eine geringe Wasserlöslichkeit auf. Es reagiert mit Wasser unter Bildung von Lithiumhydroxid, wodurch dessen Auflösung begrenzt wird. Allerdings weist es in einigen nichtwässrigen Lösungsmitteln und geschmolzenen Salzen eine gewisse Löslichkeit auf.
Zusammenfassend lässt sich sagen, dass Dilithiumoxid eine wichtige Verbindung mit unterschiedlichen Eigenschaften und Anwendungen ist. Seine stabile Struktur, seine hohen Schmelz- und Siedepunkte machen es in Branchen wie der Keramik- und Glasherstellung und als Bestandteil von Spezialbatterien wertvoll. Wenn wir seine Eigenschaften verstehen, können wir sein Potenzial für verschiedene Zwecke nutzen.
| Aussehen | Weißer Feststoff |
| Spezifisches Gewicht | 2,01 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 29,88 g/Mol |
| Dichte | 2,01 g/ml |
| Fusionspunkt | 1.450 °C (2.642 °F) |
| Siedepunkt | 2463 °C (4465 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Reagiert mit Wasser |
| Löslichkeit | Schlechte Wasserlöslichkeit, Form von Lithiumhydroxid |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Unzutreffend |
| pH-Wert | Unzutreffend |
Bitte beachten Sie, dass einige Eigenschaften wie Flammpunkt, Dampfdruck, Dampfdichte, pKa und pH aufgrund seiner chemischen Natur und seines Verhaltens für Li2O nicht anwendbar oder verfügbar sind.
Sicherheit und Gefahren von Lithiumoxid
Dilithiumoxid birgt bestimmte Sicherheitsbedenken und Gefahren. Es reagiert stark mit Wasser und produziert Lithiumhydroxid, das ätzend ist und Haut- und Augenreizungen verursachen kann. Das Einatmen von Staub oder Dämpfen kann zu Reizungen der Atemwege führen. Die Verbindung wird nicht als hochgiftig eingestuft, sollte jedoch vorsichtig gehandhabt werden, um Haut- oder Augenkontakt zu vermeiden. Bei der Arbeit mit Dilithiumoxid sind eine gute Belüftung und persönliche Schutzausrüstung unerlässlich. Im Falle einer versehentlichen Einnahme ist sofortige ärztliche Hilfe erforderlich. Darüber hinaus sollte es fern von inkompatiblen Substanzen gelagert werden, um eine mögliche Brand- oder Explosionsgefahr zu vermeiden.
| Gefahrensymbole | Ätzend |
| Sicherheitsbeschreibung | Reagiert mit Wasser. Verursacht Haut- und Augenreizungen. Mit Vorsicht behandeln. Vermeiden Sie das Einatmen von Staub oder Dämpfen. |
| UN-Identifikationsnummern | Unzutreffend |
| HS-Code | 2825.70.00 |
| Gefahrenklasse | 8 (Ätzende Stoffe) |
| Verpackungsgruppe | III |
| Toxizität | Nicht sehr giftig, aber Vorsicht geboten. Vermeiden Sie Verschlucken und Kontakt mit Haut oder Augen. |
Methoden zur Lithiumoxid-Synthese
Verschiedene Methoden ermöglichen die Synthese von Dilithiumoxid.
Ein gängiger Ansatz besteht darin, Lithiummetall mit Sauerstoff oder Luft bei hohen Temperaturen zur Reaktion zu bringen. Bei diesem Prozess erleichtert Sauerstoffgas das Erhitzen von Lithiummetall, was zur Bildung von Dilithiumoxid führt.
Eine weitere Methode ist die thermische Zersetzung von Lithiumsalzen, etwa Lithiumcarbonat oder Lithiumhydroxid , bei erhöhten Temperaturen. Durch die Einwirkung von Hitze zersetzen sich diese Salze unter Bildung von Dilithiumoxid.
Darüber hinaus kann zur Herstellung von Dilithiumoxid Lithiumhydroxid als Vorläufer verwendet werden. Durch Erhitzen wird es zunächst entwässert und in die gewünschte Oxidform umgewandelt.
Eine andere Technik beinhaltet die Verwendung von Mineralien oder Erzen, die Lithium enthalten. Aus diesen natürlichen Quellen werden durch chemische Prozesse Lithiumverbindungen gewonnen, die wiederum zu Dilithiumoxid weiterverarbeitet werden.
Es ist wichtig zu beachten, dass jede Synthesemethode spezifische Vorteile und Herausforderungen hinsichtlich Kosten, Effizienz und Reinheit mit sich bringen kann. Wissenschaftler und Ingenieure berücksichtigen diese Faktoren bei der Auswahl der am besten geeigneten Methode zur Herstellung von Dilithiumoxid, um bestimmte Industrie- oder Forschungsanforderungen zu erfüllen.
Verwendung von Lithiumoxid
Dilithiumoxid (Li2O) findet aufgrund seiner einzigartigen Eigenschaften vielseitige Anwendungen in verschiedenen Branchen. Hier sind einige wichtige Verwendungszwecke:
- Keramikindustrie: Dilithiumoxid ist ein entscheidender Bestandteil von Keramiken und verbessert deren mechanische Festigkeit und thermische Stabilität. Außerdem wird die Kochtemperatur gesenkt, wodurch beim Herstellungsprozess Energie gespart wird.
- Glasherstellung: In der Glasindustrie fungiert Dilithiumoxid als Flussmittel, das die Schmelztemperatur des Glases senkt und seine Beständigkeit gegen chemische Angriffe verbessert, was zu hochwertigen Glasprodukten führt.
- Batterietechnologie: Dilithiumoxid dient als Vorprodukt bei der Herstellung von Lithium-Ionen-Batterien. Es trägt zu den Kathodenmaterialien der Batterie bei und verbessert so deren Energiespeicherkapazität und Gesamtleistung.
- Trockenmittel: Die starke Affinität von Dilithiumoxid zu Wasser macht es zu einem wirksamen Trockenmittel, das zur Entfernung von Feuchtigkeit aus bestimmten Umgebungen verwendet wird, beispielsweise in Klimaanlagen und Gasreinigungssystemen.
- Metallurgie: In metallurgischen Prozessen hilft Dilithiumoxid bei der Raffinierung von Metallen durch die Entfernung von Verunreinigungen.
- Spezialgläser: Bei der Herstellung von Spezialgläsern für verschiedene Anwendungen wie Optik, Elektronik und wissenschaftliche Instrumente wird Dilithiumoxid verwendet.
- Katalysator: Dilithiumoxid dient bei bestimmten chemischen Reaktionen als Katalysator und erleichtert die Umwandlung von Reaktanten in gewünschte Produkte.
- Nuklearindustrie: In der Nuklearindustrie fungiert Dilithiumoxid als Neutronenmoderator und steuert die Geschwindigkeit der Kernspaltungsreaktionen.
Die Vielfalt der Anwendungen unterstreicht die Bedeutung von Dilithiumoxid für den Fortschritt von Technologie, Fertigung und wissenschaftlicher Forschung. Seine einzigartigen Eigenschaften treiben weiterhin Innovationen in verschiedenen Branchen voran und machen es zu einer wertvollen Verbindung mit einer Vielzahl praktischer Einsatzmöglichkeiten.
Fragen:
F: Welche Gleichung zeigt, dass Lithiumoxid durch die Reaktion zwischen Sauerstoff und Lithium entsteht?
A: 4Li + O2 → 2Li2O
F: Wie groß ist die Molmasse von Lithiumoxid, Li2O?
A: Die Molmasse von Li2O beträgt etwa 29,88 g/mol.
F: Wie lautet die Formel für Lithiumoxid?
A: Die Formel für Dilithiumoxid ist Li2O.
F: Ist Lithiumoxid ionisch oder kovalent?
A: Dilithiumoxid ist ionisch.
F: Wie hoch ist die Oxidationszahl von Lithium in einer Ionenbindung?
A: Die Oxidationszahl von Lithium in einer Ionenbindung beträgt +1.
F: Koordinationszahl von Lithium in Li2O?
A: Die Koordinationszahl von Lithium in Li2O beträgt 4.
F: Ist Li2O ionisch oder kovalent?
A: Li2O ist ionisch.
F: Welche der folgenden Reaktionen ist mit der Gitterenergie von Li2O (ΔH°latt) verbunden?
A: Die Reaktion: Li+(g) + O2-(g) → Li2O(s)
F: Wie groß ist die Molmasse von Lithiumoxid, Li2O?
A: Die Molmasse von Li2O beträgt etwa 29,88 g/mol.
F: Welche der folgenden Substanzen entstehen beim Verbrennen von Lithiummetall (Li)? O2, LiO, H2O, Li2O?
A: Li2O entsteht bei der Verbrennung von metallischem Lithium (Li).
F: Wie viele Gramm sind in 4,5 Mol Li2O enthalten?
A: In 4,5 Mol Li2O sind etwa 134,46 Gramm enthalten.
