Lithiumnitrat (LiNO₃) ist eine chemische Verbindung, die in verschiedenen Anwendungen eingesetzt wird. Es weist einzigartige Eigenschaften auf, wie etwa seine Wasserlöslichkeit und seine Rolle bei der Keramik- und Glasherstellung.
| IUPAC-Name | Lithiumnitrat |
| Molekularformel | LiNO₃ |
| CAS-Nummer | 7790-69-4 |
| Synonyme | Lithiumnitrat, Lithiumsalz der Salpetersäure, Lithium(I)nitrat |
| InChi | InChI=1S/Li.NO3/c;2-1(3)4/q+1;-1 |
Eigenschaften von Lithiumnitrat
Lithiumnitrat-Formel
Die Formel für das Lithiumsalz der Salpetersäure lautet LiNO₃. Es besteht aus einem Lithiumatom (Li), einem Stickstoffatom (N) und drei Sauerstoffatomen (O). Diese chemische Formel stellt die Zusammensetzung jedes Elements in der Verbindung dar.
Molmasse von Lithiumnitrat
Das Lithiumsalz der Salpetersäure hat eine Molmasse von etwa 68,95 g/mol. Die Molmasse bezieht sich auf die Masse eines Mols einer Substanz und wird durch Addition der Atommassen aller Atome in der Formel berechnet.
Siedepunkt von Lithiumnitrat
Das Lithiumsalz der Salpetersäure hat einen Siedepunkt von etwa 600 °C (1112 °F). Der Siedepunkt ist die Temperatur, bei der ein Stoff unter normalem Atmosphärendruck von einer Flüssigkeit in einen Gaszustand übergeht.
Schmelzpunkt von Lithiumnitrat
Das Lithiumsalz der Salpetersäure hat einen Schmelzpunkt von etwa 255 °C (491 °F). Der Schmelzpunkt ist die Temperatur, bei der ein Stoff unter normalem Atmosphärendruck von einem Feststoff in eine Flüssigkeit übergeht.
Dichte von Lithiumnitrat g/ml
Die Dichte des Lithiumsalzes der Salpetersäure beträgt etwa 2,38 g/ml. Die Dichte stellt die Masse einer Substanz pro Volumeneinheit dar und ist eine wichtige Eigenschaft für das Verständnis ihres physikalischen Verhaltens.
Molekulargewicht von Lithiumnitrat
Das Molekulargewicht des Lithiumsalzes der Salpetersäure beträgt 68,95 g/mol. Das Molekulargewicht ist die Summe der Atomgewichte aller Atome in einem Molekül und wird in Gramm pro Mol ausgedrückt.
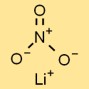
Struktur von Lithiumnitrat
Das Lithiumsalz der Salpetersäure hat eine ionische Kristallstruktur, in der Lithiumkationen (Li⁺) und Nitratanionen (NO₃⁻) ein regelmäßig wiederkehrendes Muster bilden. Diese Struktur trägt zu seiner Stabilität und seinen charakteristischen Eigenschaften bei.
Löslichkeit von Lithiumnitrat
Das Lithiumsalz der Salpetersäure ist in Wasser gut löslich. Diese hohe Löslichkeit ist eine seiner wesentlichen Eigenschaften und macht es für verschiedene Anwendungen nützlich, beispielsweise bei der Herstellung von Keramik und Glas.
| Aussehen | Weißer Feststoff |
| Spezifisches Gewicht | N / A |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 68,95 g/Mol |
| Dichte | 2,38 g/ml |
| Fusionspunkt | 255 °C (491 °F) |
| Siedepunkt | 600 °C (1112 °F) |
| Blitzpunkt | N / A |
| Löslichkeit in Wasser | Sehr löslich |
| Löslichkeit | Löslich in Wasser und organischen Lösungsmitteln wie Ethanol |
| Dampfdruck | N / A |
| Wasserdampfdichte | N / A |
| pKa | N / A |
| pH-Wert | N / A |
Bitte beachten Sie, dass einige Eigenschaften möglicherweise nicht anwendbar sind (N/A) oder nur begrenzte Daten für Lithiumnitrat verfügbar sind.
Sicherheit und Gefahren von Lithiumnitrat
Das Lithiumsalz der Salpetersäure wirft bestimmte Sicherheits- und Gefahrenaspekte auf. Bei Kontakt oder Einatmen kann es zu Reizungen der Haut, der Augen und der Atemwege kommen. Bei der Handhabung ist unbedingt entsprechende Schutzausrüstung wie Handschuhe und Schutzbrille zu verwenden. Vermeiden Sie die Einnahme, da dies zu Magen-Darm-Beschwerden führen kann. Bewahren Sie es fern von unverträglichen Substanzen auf, um gefährliche Reaktionen zu vermeiden. Sollten verschüttete Flüssigkeiten oder Undichtigkeiten auftreten, dämmen Sie diese sofort ein und reinigen Sie sie. Befolgen Sie außerdem immer die richtigen Lagerungsrichtlinien und bewahren Sie es an einem sicheren, gut belüfteten Ort auf. Priorisieren Sie sichere Handhabungspraktiken und befolgen Sie relevante Sicherheitsprotokolle, um die mit dem Lithiumsalz der Salpetersäure verbundenen Risiken zu minimieren.
| Gefahrensymbole | Warnung |
| Sicherheitsbeschreibung | – Reizt Haut, Augen und Atemwege. – Verschlucken vermeiden. – Schutzausrüstung verwenden. – An einem gut belüfteten Ort aufbewahren. |
| UN-Identifikationsnummern | UN1477 |
| HS-Code | 28342990 |
| Gefahrenklasse | 5.1 (Oxidationsmittel) |
| Verpackungsgruppe | II |
| Toxizität | Geringe Toxizität, sollte jedoch mit Vorsicht und geeigneten Sicherheitsmaßnahmen gehandhabt werden. |
Bitte beachten Sie, dass spezifische Gefahrensymbole und Sicherheitsempfehlungen je nach Rechtsprechung und Vorschriften variieren können. Beachten Sie beim Umgang mit dem Lithiumsalz der Salpetersäure stets die entsprechenden Sicherheitsdatenblätter und örtlichen Sicherheitsrichtlinien.
Methoden zur Lithiumnitrat-Synthese
Es gibt verschiedene Methoden zur Synthese des Lithiumsalzes der Salpetersäure.
Ein gängiger Ansatz beinhaltet die Reaktion zwischen Lithiumcarbonat (Li₂CO₃) und Salpetersäure (HNO₃) . Während dieses Prozesses reagieren die beiden Verbindungen unter Bildung des Lithiumsalzes der Salpetersäure und Wasser (H₂O) als Nebenprodukte. Die chemische Gleichung für diese Reaktion lautet:
Li₂CO₃ + 2HNO₃ → 2LiNO₃ + H₂O
Eine andere Methode besteht darin, Lithiumhydroxid (LiOH) mit Salpetersäure umzusetzen, um ein Lithiumsalz aus Salpetersäure und Wasser zu erhalten. Die Reaktionsgleichung lautet:
LiOH + HNO₃ → LiNO₃ + H₂O
Das Lithiumsalz der Salpetersäure entsteht durch Neutralisation von Salpetersäure mit Lithiumoxid (Li₂O) oder Lithiumcarbonat. Die Gleichungen lauten:
Li₂O + 2HNO₃ → 2LiNO₃ + H₂O Li₂CO₃ + 2HNO₃ → 2LiNO₃ + CO₂ + H₂O
Bei all diesen Methoden ist es wichtig, die Reagenzien und Produkte aufgrund ihrer Reaktivität und potenziellen Gefahren mit Vorsicht zu handhaben. Während des Syntheseprozesses sind geeignete Sicherheitsmaßnahmen und kontrollierte Bedingungen unerlässlich, um eine erfolgreiche Produktion des Lithiumsalzes der Salpetersäure sicherzustellen.
Verwendung von Lithiumnitrat
Das Lithiumsalz der Salpetersäure findet aufgrund seiner einzigartigen Eigenschaften vielfältige Anwendungen. Hier sind seine Verwendungsmöglichkeiten:
- Luftaufbereitung: Das Lithiumsalz der Salpetersäure fungiert bei Luftaufbereitungsanwendungen als Trockenmittel und entfernt Feuchtigkeit aus der Luft, um Korrosion zu verhindern und optimale Umgebungsbedingungen aufrechtzuerhalten.
- Reagenzien in der chemischen Synthese: Es dient als Quelle für Nitrationen in verschiedenen chemischen Reaktionen und ist daher bei der Synthese anderer Verbindungen und Substanzen nützlich.
- Spezialchemikalien: Diese finden Anwendung bei der Herstellung von Spezialchemikalien, einschließlich Katalysatoren und Korrosionsinhibitoren.
- Pyrotechnik und Feuerwerk: Das Lithiumsalz der Salpetersäure spielt als Oxidationsmittel in der Pyrotechnik eine entscheidende Rolle und trägt zur leuchtend roten Farbe von Feuerwerkskörpern bei.
- Pharmazeutische Industrie: Die pharmazeutische Industrie verwendet das Lithiumsalz der Salpetersäure als Reagens in der chemischen Synthese und Forschung für bestimmte pharmazeutische Formulierungen.
- Lithiumbatterien: Obwohl das Lithiumsalz der Salpetersäure nicht direkt in Batterien verwendet wird, ist es für die Lithium-Ionen-Batterieindustrie relevant. Hersteller verwenden Lithiumsalze, die aus dem Lithiumsalz der Salpetersäure gewonnen werden, in die in diesen Batterien verwendeten Elektrolyte.
- Kernreaktoren: Einige Arten von Kernreaktoren verwenden Lithiumsalz der Salpetersäure aufgrund seiner Neutronenabsorptionseigenschaften als Kühlmittel.
- Keramik- und Glasherstellung: Bei der Keramik- und Glasherstellung dient das Lithiumsalz der Salpetersäure als Flussmittel. Es senkt effektiv den Schmelzpunkt von Materialien und verbessert so deren Verarbeitbarkeit und Produktqualität.
- Wärmeübertragungsflüssigkeiten: Das Lithiumsalz der Salpetersäure findet aufgrund seiner hohen Löslichkeit in Wasser Anwendung in Wärmeübertragungsflüssigkeiten, insbesondere in Solarenergiesystemen. Es ermöglicht einen effizienten Wärmeaustausch und ermöglicht die Speicherung thermischer Energie.
Fragen:
F: Wie viele Atome gibt es insgesamt in einem Molekül Lithiumnitrat, LiNO₃?
A: Ein Molekül des Lithiumsalzes der Salpetersäure besteht aus 5 Atomen: 1 Lithiumatom (Li), 1 Stickstoffatom (N) und 3 Sauerstoffatome (O).
F: Wie lauten die richtigen Formeln für Kupfer(II)-nitrat-Hexahydrat und Lithiumchromat-Dihydrat?
A: Die korrekten Formeln sind Cu(NO₃)₂·6H₂O für Kupfer(II)-nitrat-Hexahydrat und Li₂CrO₄·2H₂O für Lithiumchromat-Dihydrat.
F: Wie viele Gramm Lithiumnitrat werden benötigt, um 250 ml einer 0,5 M Lösung herzustellen?
A: Sie benötigen 17,24 Gramm Lithiumsalz der Salpetersäure, um 250 ml einer 0,5 M Lösung herzustellen.
F: Ist Lithiumnitrat ionisch oder kovalent?
A: Das Lithiumsalz der Salpetersäure ist eine ionische Verbindung.
F: Ist LiNO₃ wasserlöslich?
A: Ja, Lithiumnitrat (LiNO₃) ist wasserlöslich.
F: Welcher Koeffizient sollte in der ausgeglichenen Gleichung vor LiNO₃ erscheinen?
A: Der Koeffizient „2“ muss in der ausgeglichenen Gleichung vor LiNO₃ erscheinen.
F: Wie viele der folgenden Verbindungen sind wasserlöslich? Pb(OH)₂, LiNO₃, NH₄Br, K₂S
A: Drei der Verbindungen sind wasserlöslich: LiNO₃, NH₄Br und K₂S.
F: Ist LiNO₃ löslich?
A: Ja, LiNO₃ ist löslich.
F: Ist LiNO₃ wässrig oder fest?
A: LiNO₃ ist wässrig, wenn es in Wasser gelöst wird.
F: Ist LiNO₃ sauer, basisch oder neutral?
A: Das Lithiumsalz der Salpetersäure (LiNO₃) ist eine neutrale Verbindung.
F: Wie viele Atome gibt es insgesamt in einem Molekül Lithiumnitrat, LiNO₃?
A: Ein Lithiumnitratmolekül besteht aus 5 Atomen: 1 Lithiumatom (Li), 1 Stickstoffatom (N) und 3 Sauerstoffatomen (O).
F: Ist LiNO₃ ionisch oder kovalent?
A: LiNO₃ ist eine ionische Verbindung.
