Bleioxid (PbO) ist eine Verbindung aus Blei und Sauerstoff. Aufgrund seiner besonderen Eigenschaften und Anwendungen wird es bei der Herstellung von Batterien, Keramik und Glas verwendet.
| IUPAC-Name | Blei(II)-oxid |
| Molekularformel | PbO |
| CAS-Nummer | 1317-36-8 |
| Synonyme | Bleimonoxid, Blei(II)-oxid, Litharge |
| InChI | InChI=1S/2O.Pb |
Eigenschaften von Bleioxid
Bleioxid-Formel
Die chemische Formel für Bleimonoxid lautet PbO. Es besteht aus einem Bleiatom (Pb) und einem Sauerstoffatom (O), was zu einer einfachen, wohldefinierten Molekülstruktur führt.
Molmasse von Bleioxid
Die Molmasse von Bleimonoxid (PbO) beträgt etwa 223,2 Gramm pro Mol (g/mol). Dieser Wert ergibt sich aus der Addition der Atommassen eines Bleiatoms und eines Sauerstoffatoms.
Siedepunkt von Bleioxid
Bleimonoxid hat keinen eindeutigen Siedepunkt, da es sich zersetzt, bevor es seinen Siedepunkt erreicht. Beim Erhitzen verwandelt es sich in metallisches Blei und Sauerstoffgas.
Schmelzpunkt von Bleioxid
Der Schmelzpunkt von Bleimonoxid (PbO) liegt bei etwa 888 °C (1.630 °F). Bei dieser Temperatur verwandelt sich festes Bleimonoxid in eine geschmolzene Flüssigkeit, was verschiedene industrielle Anwendungen ermöglicht.
Bleioxiddichte g/ml
Bleimonoxid hat eine Dichte von etwa 9,53 Gramm pro Milliliter (g/ml). Diese hohe Dichte macht es in verschiedenen Branchen wie der Keramik- und Glasproduktion nützlich.
Molekulargewicht von Bleioxid
Das Molekulargewicht von Bleimonoxid (PbO) beträgt 223,2 g/mol. Dieser Wert stellt die Summe der Atommassen von Blei und Sauerstoff in einem einzelnen Molekül Bleimonoxid dar.
Struktur von Bleioxid
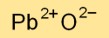
Bleimonoxid hat eine Kristallgitterstruktur, wobei Bleikationen (Pb2+) Positionen im Gitter einnehmen und Oxidanionen (O2-) die Zwischenräume füllen. Durch diese Anordnung entsteht eine stabile Ionenbindung.
Löslichkeit von Bleioxid
Bleimonoxid (PbO) hat eine geringe Wasserlöslichkeit. Es löst sich nur wenig in Wasser und bildet durch Hydrolyse von Bleikationen eine basische Lösung. Seine Löslichkeit kann in sauren Umgebungen zunehmen.
| Aussehen | Gelbes oder rotes Pulver |
| Spezifisches Gewicht | 9,53 g/ml |
| Farbe | Gelb oder Rot |
| Geruch | Geruchlos |
| Molmasse | 223,2 g/Mol |
| Dichte | 9,53 g/cm³ |
| Fusionspunkt | 888 °C (1630 °F) |
| Siedepunkt | Zerfällt vor dem Kochen |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Schwach löslich |
| Löslichkeit | Geringe Löslichkeit, kann in sauren Umgebungen zunehmen |
| Dampfdruck | Nicht verfügbar |
| Wasserdampfdichte | Nicht verfügbar |
| pKa | Unzutreffend |
| pH-Wert | Basisch (in wässriger Lösung) |
Sicherheit und Gefahren von Bleioxid
Bleimonoxid stellt ein potenzielles Sicherheitsrisiko dar und erfordert eine sorgfältige Handhabung. Das Einatmen oder Verschlucken von Bleimonoxidstaub oder -dämpfen kann zu einer Bleivergiftung führen, die sich negativ auf das Nervensystem und die Organe auswirkt. Beim Umgang mit dieser Verbindung sind ausreichende Belüftung und persönliche Schutzausrüstung unerlässlich. Vermeiden Sie den Kontakt mit Augen, Haut oder Kleidung, um Reizungen zu vermeiden. Darüber hinaus ist Bleimonoxid schädlich für Wasserlebewesen und die Umwelt. eine Einleitung in Gewässer ist unbedingt zu vermeiden. Um Risiken zu minimieren, sollten geeignete Lagerungs- und Entsorgungsmethoden befolgt werden. Befolgen Sie beim Arbeiten mit Bleimonoxid stets die Sicherheitshinweise und behördlichen Maßnahmen.
| Gefahrensymbole | Gefahr für die Gesundheit |
| Sicherheitsbeschreibung | – Einatmen oder Verschlucken kann zu Bleivergiftungen und Organschäden führen. – Vermeiden Sie den Kontakt mit Augen und Haut, um Reizungen zu vermeiden. – Bei ausreichender Belüftung und persönlicher Schutzausrüstung handhaben. Freisetzung in die Umwelt vermeiden. Befolgen Sie die Sicherheitshinweise. |
| UN-Identifikationsnummern | UN3077 |
| HS-Code | 2824.90.7000 |
| Gefahrenklasse | 9 (Verschiedene gefährliche Materialien und Gegenstände) |
| Verpackungsgruppe | III |
| Toxizität | Giftig für Wasserorganismen mit langfristiger Wirkung. |
Methoden zur Bleioxid-Synthese
Die Synthese von Bleimonoxid umfasst mehrere Methoden. Ein gängiger Ansatz ist die thermische Zersetzung von Bleinitrat, bei der wir das Bleinitrat (Pb(NO3)2) auf eine bestimmte Temperatur erhitzen. Bei diesem Prozess wird Bleinitrat in Bleimonoxid (PbO), Stickstoffdioxid (NO2) und Sauerstoffgas (O2) zerlegt. Die chemische Reaktion stellt dar:
2 Pb(NO3)2 → 2 PbO + 4 NO2 + O2
Eine andere Methode beinhaltet die Oxidation von metallischem Blei. Metallisches Blei reagiert mit Sauerstoff unter Bildung von Bleimonoxid:
2 Pb + O2 → 2 PbO
Darüber hinaus entsteht Bleimonoxid, wenn Blei unter sauren Bedingungen korrodiert wird. In diesem Szenario reagiert Blei mit Sauerstoff und Wasser unter Bildung von Bleimonoxid:
2 Pb + 2 H2O + O2 → 2 PbO + 2 H2O
Diese Methoden sind für die Herstellung von Bleimonoxid für verschiedene Anwendungen von entscheidender Bedeutung, beispielsweise für die Herstellung von Batterien, Keramik und Pigmenten. Allerdings ist es wichtig, mit Bleiverbindungen aufgrund ihrer potenziellen Gesundheits- und Umweltrisiken vorsichtig umzugehen.
Verwendung von Bleioxid
Aufgrund seiner einzigartigen Eigenschaften findet Bleimonoxid vielfältige Anwendungen in verschiedenen Branchen. Hier sind die häufigsten Verwendungszwecke:
- Keramik: Es fungiert als Fließmittel bei der Keramikproduktion und verbessert die Schmelzeigenschaften und die Gesamtqualität von Keramikmaterialien.
- Strahlenschutz: Aufgrund seiner hohen Dichte und Effizienz bei der Strahlungsabsorption ist Bleimonoxid ein geeignetes Material für den Strahlenschutz in medizinischen Einrichtungen und der Nuklearindustrie.
- PVC-Stabilisator: Es dient als Wärmestabilisator und Schmiermittel bei der Verarbeitung von Polyvinylchlorid (PVC) und unterstützt die Herstellung von PVC-Rohren, -Kabeln und anderen Produkten.
- Halbleiterbauelemente: Es dient als Material in einigen Halbleiterbauelementen, z. B. Bleimonoxid-Varistoren, die zum Schutz vor Überspannungen verwendet werden.
- Blei-Säure-Batterien: Blei-Säure-Batterien verwenden Bleimonoxid als wesentlichen Bestandteil und verleihen ihnen die erforderlichen Eigenschaften für den Einsatz in Fahrzeugen, Notstromversorgungen und unterbrechungsfreien Stromquellen.
- Glasherstellung: Bleimonoxid spielt eine entscheidende Rolle bei der Herstellung von Bleiglas, da es ihm einen erhöhten Brechungsindex und eine höhere Brillanz verleiht und es somit ideal für dekorative und optische Zwecke eignet.
- Pigmentanwendung: Farben und Beschichtungen profitieren aufgrund ihrer lebendigen Farben und Witterungsbeständigkeit von verschiedenen Bleipigmenten wie Minium (Pb3O4).
- Verwendung in der Gummiindustrie: Die Gummiindustrie verwendet Bleimonoxid als Beschleuniger und Vulkanisationsmittel und verbessert so effektiv die Eigenschaften und Haltbarkeit von Gummiprodukten.
Obwohl Bleimonoxid wichtige industrielle Anwendungen hat, ist es aufgrund seiner potenziellen Gesundheits- und Umweltrisiken wichtig, vorsichtig damit umzugehen. Um den verantwortungsvollen Einsatz in verschiedenen Branchen sicherzustellen, sind geeignete Sicherheitsmaßnahmen und -vorschriften unerlässlich.
Fragen:
F: Welche der folgenden Gleichungen stellt die Zersetzung von Blei(IV)-oxid dar?
A: Die ausgewogene Gleichung für die Zersetzung von Blei(IV)-oxid lautet PbO2 → PbO + O2.
F: Wie lautet die chemische Formel für Blei(IV)-oxid?
A: Die chemische Formel für Blei(IV)-oxid lautet PbO2.
F: Wie viele Gramm Blei(II)-oxid werden aus 86,5 Gramm Kaliumiodid hergestellt?
A: Um die produzierten Gramm Blei(II)-oxid zu bestimmen, benötigen wir eine chemische Reaktionsgleichung zwischen Kaliumiodid und PbO.
F: Was ist Bleimonoxid?
A: Bleimonoxid bezieht sich auf jede Verbindung, die Blei und Sauerstoff enthält, und es kommt in verschiedenen Formen vor, einschließlich Blei(II)-oxid (PbO) und Blei(IV)-oxid (PbO2).
F: 0,632 Mol Blei wurden zu Blei(II)-nitrat oxidiert. Wie viele Mol Silber würden abgeschieden?
A: Um die Mole an abgeschiedenem Silber zu berechnen, benötigen wir eine ausgewogene chemische Gleichung, die die Reduktion von Blei(II)-nitrat zu Silber darstellt.
F: Wie heißt PbO?
A: Der Name für PbO ist Blei(II)-oxid.
F: Wie hoch ist die Oxidationszahl von Blei?
A: Die Oxidationszahl von Blei in PbO beträgt +2 und in PbO2 +4.
F: Ist PbO amphoter?
A: Nein, PbO ist nicht amphoter; es weist keine sauren oder basischen Eigenschaften auf.
F: Was ist PbO?
A: PbO ist die chemische Formel für Blei(II)-oxid, eine Verbindung, die in verschiedenen Anwendungen einschließlich Blei-Säure-Batterien und der Glasherstellung verwendet wird.
F: Wie lässt sich die Gleichung Pb(NO3)2 = PbO + NO2 + O2 ausgleichen?
A: Die ausgewogene Gleichung für die Zersetzung von Blei(II)-nitrat (Pb(NO3)2) lautet 2Pb(NO3)2 = 2PbO + 4NO2 + O2.
