Quecksilberchlorid ist eine giftige Verbindung mit der Formel HgCl2. Es handelt sich um einen weißen kristallinen Feststoff, der in Labors als Reagenz und Desinfektionsmittel verwendet wird. Eine ordnungsgemäße Handhabung ist jedoch unerlässlich.
| IUPAC-Name | Quecksilber(II)-chlorid |
| Molekularformel | HgCl2 |
| CAS-Nummer | 7487-94-7 |
| Synonyme | Quecksilberdichlorid, Quecksilberdichlorid, Quecksilberbichlorid, Quecksilber(II)-dichlorid |
| InChI | InChI=1S/2ClH.Hg/h2*1H;/q;;+2/p-2 |
Eigenschaften von Quecksilberchlorid
Quecksilberchlorid-Formel
Die Formel für Quecksilberdichlorid lautet HgCl2. Es besteht aus einem Quecksilberatom (Hg) und zwei Chloratomen (Cl). Diese Verbindung ist auch als Quecksilber(II)-chlorid bekannt und symbolisiert die Oxidationsstufe +2 von Quecksilber.
Molmasse von Quecksilberchlorid
Die Molmasse von Quecksilberdichlorid beträgt etwa 271,52 g/mol. Sie wird durch Addition der Atommassen eines Quecksilberatoms (200,59 g/mol) und zweier Chloratome (jeweils 35,45 g/mol) berechnet.
Siedepunkt von Quecksilberchlorid
Quecksilberdichlorid hat einen Siedepunkt von etwa 302 °C (575,6 °F). Bei dieser Temperatur wandelt sich festes Quecksilberdichlorid in Dampf um.
Schmelzpunkt von Quecksilberchlorid
Der Schmelzpunkt von Quecksilberdichlorid liegt bei etwa -71 °C (-95,8 °F). Bei dieser Temperatur wird festes Quecksilberdichlorid flüssig.
Dichte von Quecksilberchlorid g/ml
Die Dichte von Quecksilberdichlorid beträgt etwa 5,4 g/ml. Diese hohe Dichte macht es zu einem relativ schweren Stoff.
Molekulargewicht von Quecksilberchlorid
Das Molekulargewicht von Quecksilberdichlorid beträgt etwa 271,52 g/mol. Sie gibt die Masse eines Mols der Verbindung an und entspricht der Summe ihrer Atomgewichte.
Struktur von Quecksilberchlorid
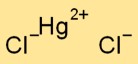
Quecksilberdichlorid hat eine kristalline Struktur. Es besteht aus positiv geladenen Quecksilberionen (Hg2+) und negativ geladenen Chloridionen (Cl-), die durch Ionenbindungen zusammengehalten werden. Die Anordnung bildet ein gitterartiges Muster.
Löslichkeit von Quecksilberchlorid
Quecksilberdichlorid ist in Wasser nur begrenzt löslich. Ungefähr 7,7 Gramm Quecksilberdichlorid können sich bei Raumtemperatur (20 °C) in 100 ml Wasser lösen. Seine Löslichkeit nimmt mit steigenden Temperaturen zu.
Quecksilberdichlorid ist eine hochgiftige Substanz und sollte mit äußerster Vorsicht gehandhabt werden. Es wird häufig in verschiedenen Anwendungen eingesetzt, unter anderem als Reagenz in chemischen Labors, als Desinfektionsmittel und in Galvanisierungsprozessen. Aufgrund seiner Toxizität ist es wichtig, bei der Arbeit mit dieser Verbindung die richtigen Sicherheitsprotokolle einzuhalten.
| Aussehen | Weißer kristalliner Feststoff |
| Spezifisches Gewicht | 5,4 g/ml |
| Farbe | Weiß |
| Geruch | Geruchlos |
| Molmasse | 271,52 g/Mol |
| Dichte | 5,4 g/ml |
| Fusionspunkt | -71 °C (-95,8 °F) |
| Siedepunkt | 302 °C (575,6 °F) |
| Blitzpunkt | Unzutreffend |
| Löslichkeit in Wasser | Grenze |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie Alkohol, Ether |
| Dampfdruck | Unerheblich |
| Wasserdampfdichte | 8,23 (Luft = 1) |
| pKa | Unzutreffend |
| pH-Wert | Säure (in Wasser) |
Sicherheit und Gefahren von Quecksilberchlorid
Quecksilberdichlorid birgt aufgrund seiner extremen Toxizität erhebliche Sicherheitsrisiken. Direkter Hautkontakt oder das Einatmen der Dämpfe kann zu ernsthaften Gesundheitsschäden führen. Es ist wichtig, mit großer Vorsicht damit umzugehen und geeignete Schutzausrüstung wie Handschuhe und Atemschutzmaske zu verwenden. Arbeiten Sie immer in einem gut belüfteten Bereich, um die Exposition zu minimieren. Bewahren Sie es in dicht verschlossenen Behältern fern von unverträglichen Substanzen auf. Bei Verschlucken oder versehentlicher Exposition sofort einen Arzt aufsuchen. Um eine Kontamination der Umwelt zu vermeiden, müssen ordnungsgemäße Entsorgungsmethoden befolgt werden. Insgesamt ist die strikte Einhaltung der Sicherheitsprotokolle beim Umgang mit Quecksilberdichlorid von entscheidender Bedeutung.
| Gefahrensymbole | Totenkopf mit gekreuzten Knochen, ätzend |
| Sicherheitsbeschreibung | Sehr giftig und ätzend. Mit äußerster Vorsicht verwenden. Vermeiden Sie direkten Kontakt und das Einatmen von Dämpfen. |
| UN-Identifikationsnummern | UN1624 (Quecksilberverbindungen, nag) |
| HS-Code | 2852.10.10 |
| Gefahrenklasse | 6.1 (Giftige Stoffe) |
| Verpackungsgruppe | II (Mittelstufe) |
| Toxizität | Extrem giftig für Mensch und Tier. Gehen Sie vorsichtig damit um und befolgen Sie strenge Sicherheitsprotokolle. |
Methoden zur Synthese von Quecksilberchlorid
Es gibt verschiedene Methoden zur Synthese von Quecksilberdichlorid.
Ein gängiger Ansatz ist die Reaktion von metallischem Quecksilber mit Salzsäure . Fügen Sie der Säure in einer kontrollierten Umgebung Quecksilber hinzu, um Quecksilberdichlorid zu erzeugen und Wasserstoffgas freizusetzen. Die chemische Gleichung für diese Reaktion lautet:
Hg + 2HCl -> HgCl2 + H2
Eine andere Methode nutzt die Reaktion zwischen Quecksilberoxid (HgO) und Salzsäure . Kombinieren Sie Quecksilberoxid mit Säure, um Quecksilberdichlorid und Wasser zu bilden:
HgO + 2HCl -> HgCl2 + H2O
Darüber hinaus kann Quecksilberdichlorid durch die Reaktion von Quecksilber mit Chlorgas hergestellt werden:
Hg + Cl2 -> HgCl2
Denken Sie daran, die Synthese von Quecksilberdichlorid aufgrund seiner toxischen und ätzenden Natur nur unter einer gut belüfteten Haube oder unter kontrollierten Bedingungen durchzuführen. Um eine schädliche Belastung während des Syntheseprozesses zu vermeiden, sind eine sorgfältige Handhabung und die Einhaltung von Sicherheitsvorkehrungen unerlässlich.
Verwendung von Quecksilberchlorid
Quecksilberdichlorid, auch bekannt als Quecksilber(II)-chlorid, hat aufgrund seiner einzigartigen Eigenschaften vielfältige Anwendungen in unterschiedlichen Bereichen gefunden. Hier sind einige seiner Hauptanwendungen:
Laborreagenz: Quecksilberdichlorid dient als wichtiges Reagenz in chemischen Labors für verschiedene analytische und synthetische Verfahren.
Desinfektionsmittel: Seine starken antimikrobiellen Eigenschaften machen es zu einem wertvollen Desinfektionsmittel, insbesondere zum Sterilisieren von Geräten und Oberflächen.
Medizin: Obwohl es aufgrund seiner Toxizität begrenzt ist, wird es in der traditionellen Medizin bei bestimmten Erkrankungen eingesetzt.
Fotografie: In der frühen Fotografie spielte Quecksilberchlorid als Fixiermittel für die Entwicklung von Fotografien eine Rolle.
Galvanisieren: Beim Galvanisieren verwenden Menschen Quecksilberdichlorid als Elektrolyt, um metallische Beschichtungen auf verschiedenen Objekten abzuscheiden.
Holzschutz: Im Laufe der Geschichte haben Menschen es zur Behandlung von Holz verwendet, um es vor Fäulnis und Schädlingen zu schützen.
Textilindustrie: Hersteller verwendeten Quecksilberchlorid, um Textilien während des Färbeprozesses zu entfärben.
Analytische Chemie: Chemiker nutzen sie für spezifische Tests und Reaktionen in der chemischen Analyse.
Organische Nischensynthese: Sie findet Anwendung in spezifischen organischen Synthesereaktionen.
Fungizid und Algizid: Landwirte setzen es aktiv als Fungizid und Algizid ein, um das Wachstum von Pilzen und Algen in der Landwirtschaft zu kontrollieren.
Fragen:
F: Ist HgCl2 in Wasser löslich oder unlöslich?
A: HgCl2 ist in Wasser schwer löslich.
F: Was sind das Kation und Anion der Verbindung HgCl2?
A: Das Kation ist Hg2+ (Quecksilber) und das Anion ist Cl- (Chlorid).
F: Ist HgCl2 ionisch oder kovalent?
A: HgCl2 ist eine ionische Verbindung.
F: Wie stellt man Quecksilberchlorid in Minecraft her?
A: In Minecraft kann Quecksilberdichlorid durch die Kombination von Quecksilber und Chlor in einer Herstellungstabelle synthetisiert werden.
F: Wofür wird Quecksilberchlorid verwendet?
A: Quecksilberdichlorid wird in Labors als Reagenz und Desinfektionsmittel verwendet.
F: Wer hat Quecksilberchlorid erfunden?
A: Die Entdeckung und erste Verwendung von Quecksilberdichlorid reicht bis in die Antike zurück, daher gibt es kein spezifisches Inventar.
F: Wie stellt man Quecksilberchlorid in der Minecraft Education Edition her?
A: In der Minecraft Education Edition kann Quecksilberdichlorid durch die Kombination von Quecksilber und Chlor in einem Basteltisch hergestellt werden, genau wie in der Standardversion von Minecraft.
F: Was ist Quecksilberchlorid?
A: Quecksilberdichlorid ist eine giftige Verbindung mit der chemischen Formel HgCl2.
F: Ist HgCl2 ein Feststoff?
A: Ja, HgCl2 ist bei Raumtemperatur ein Feststoff.
F: Wie lautet der korrekte Name für HgCl2 in der ionischen Benennung?
A: Der korrekte Name für HgCl2 in der ionischen Benennung ist Quecksilber(II)-dichlorid.
F: Wie heißt HgCl2?
A: Der Name von HgCl2 ist Quecksilberdichlorid.
F: 2 HgCl2(aq) + C2O4^(2-)(aq) → 2 Cl^-(aq) + 2 CO2(g) + Hg2Cl2(s), wie lautet das Geschwindigkeitsgesetz der Reaktion?
A: Geschwindigkeitsgesetz: Rate = k[HgCl2]^2[C2O4^2-] (zweite Ordnung in Bezug auf HgCl2 und erste Ordnung in Bezug auf C2O4^2-).
