Schwefelkohlenstoff ist eine flüchtige chemische Verbindung, die durch die Verbindung von Kohlenstoff und Schwefel entsteht. Es wird in industriellen Prozessen, bei der Herstellung von Lösungsmitteln und Viskosefasern verwendet.
| IUPAC-Name | Schwefelkohlenstoff |
| Molekularformel | CS2 |
| CAS-Nummer | 75-15-0 |
| Synonyme | Schwefelkohlenstoff, Dithiocarb, Schwefelkohlenstoff |
| InChI | InChI=1S/CS2/c2-1-3 |
Eigenschaften von Schwefelkohlenstoff
Schwefelkohlenstoffformel
Die chemische Formel für Schwefelkohlenstoff lautet CS2. Es besteht aus einem Kohlenstoffatom und zwei Schwefelatomen, die linear miteinander verbunden sind. Diese einfache Formel ist wichtig, um die Grundzusammensetzung der Verbindung zu verstehen.
Kohlenstoffdisulfid-Molmasse
Die Molmasse von Schwefelkohlenstoff beträgt etwa 76,14 g/mol. Um dies zu berechnen, addieren wir die Atommassen eines Kohlenstoffatoms (12,01 g/mol) und zweier Schwefelatome (jeweils 32,06 g/mol). Die Kenntnis der Molmasse hilft bei verschiedenen chemischen Berechnungen.
Siedepunkt von Schwefelkohlenstoff
Schwefelkohlenstoff hat einen relativ niedrigen Siedepunkt von etwa 46,3 °C (115,3 °F). Diese Eigenschaft macht es flüchtig und leicht verdampfbar. Sein niedriger Siedepunkt ist wichtig für industrielle Prozesse und Anwendungen, die eine schnelle Verdampfung erfordern.
Schmelzpunkt von Schwefelkohlenstoff
Der Schmelzpunkt von Schwefelkohlenstoff liegt bei etwa -110,8 °C (-187,4 °F). Bei Temperaturen unterhalb dieses Punktes verbleibt es im festen Zustand und geht beim Erhitzen in den flüssigen Zustand über. Für die Handhabung und Lagerung ist es von entscheidender Bedeutung, den Schmelzpunkt zu kennen.
Dichte von Schwefelkohlenstoff g/ml
Die Dichte von Schwefelkohlenstoff beträgt bei Raumtemperatur etwa 1,26 g/ml. Dieser Wert bedeutet seine Masse pro Volumeneinheit. Da es dichter als Wasser ist, sinkt es beim Mischen und seine Dichte beeinflusst seine Löslichkeit in verschiedenen Lösungsmitteln.
Molekulargewicht von Kohlenstoffdisulfid
Das Molekulargewicht von Schwefelkohlenstoff beträgt etwa 76,14 g/mol, berechnet aus seiner chemischen Formel. Dieser Wert spielt eine wesentliche Rolle bei der Stöchiometrie und bei der Bestimmung der Verbindungsmenge bei chemischen Reaktionen.
Struktur von Schwefelkohlenstoff
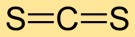
Kohlenstoffdisulfid hat eine lineare Molekülstruktur mit dem Kohlenstoffatom im Zentrum und Schwefelatomen auf beiden Seiten. Diese einfache Anordnung ist entscheidend für das Verständnis seines chemischen Verhaltens und seiner Wechselwirkungen mit anderen Substanzen.
Löslichkeit von Schwefelkohlenstoff
Schwefelkohlenstoff ist in Wasser schlecht löslich, bei Raumtemperatur sind es nur etwa 0,2 g pro 100 ml Wasser. Allerdings ist es in organischen Lösungsmitteln wie Benzol und Ethanol sehr gut löslich. Dieses Löslichkeitsverhalten ist für verschiedene Anwendungen in Chemie und Industrie wesentlich.
| Aussehen | Farblose Flüssigkeit |
| Spezifisches Gewicht | 1.26 |
| Farbe | Farblos |
| Geruch | Scharfes und süßes Aroma |
| Molmasse | 76,14 g/Mol |
| Dichte | 1,26 g/ml |
| Fusionspunkt | -110,8 °C (-187,4 °F) |
| Siedepunkt | 46,3 °C (115,3 °F) |
| Blitzpunkt | -30°C (-22°F) |
| Löslichkeit in Wasser | 0,2g/100ml (20°C) |
| Löslichkeit | Löslich in organischen Lösungsmitteln wie Benzol und Ethanol |
| Dampfdruck | 318 mmHg (20°C) |
| Wasserdampfdichte | 2,62 (Luft = 1) |
| pKa | ~ -2 |
| pH-Wert | Neutral (pH 7) |
Sicherheit und Gefahren von Schwefelkohlenstoff
Schwefelkohlenstoff birgt erhebliche Sicherheitsrisiken. Es ist leicht entzündlich und seine Dämpfe können in der Luft explosive Gemische bilden. Längerer Kontakt kann zu Schwindel, Kopfschmerzen und sogar Bewusstlosigkeit führen. Es ist außerdem schädlich für Wasserlebewesen und die Umwelt. Um Risiken zu minimieren, sind eine ausreichende Belüftung, persönliche Schutzausrüstung und eine feuersichere Lagerung unerlässlich. Vermeiden Sie den Kontakt mit Haut und Augen, da dies zu Reizungen und Schäden führen kann. Die Handhabung sollte in gut kontrollierten Umgebungen erfolgen und verschüttete Flüssigkeiten sollten schnell eingedämmt werden. Das Verstehen und Befolgen der Sicherheitsanweisungen ist für die Vermeidung von Unfällen und die Gewährleistung einer sicheren Arbeitsumgebung beim Umgang mit Schwefelkohlenstoff von entscheidender Bedeutung.
| Gefahrensymbole | Entzündlich, gesundheitsschädlich |
| Sicherheitsbeschreibung | Leicht entzündliche Flüssigkeit und Dampf. Gesundheitsschädlich beim Einatmen oder Verschlucken. Verursacht Haut- und Augenreizungen. |
| UN-Identifikationsnummern | UN1131 |
| HS-Code | 2813.10.1000 |
| Gefahrenklasse | 3 (Brennbare Flüssigkeiten) |
| Verpackungsgruppe | II (mittlere Gefahr) |
| Toxizität | Mäßige Toxizität |
Methoden zur Synthese von Schwefelkohlenstoff
Mehrere aktive Methoden ermöglichen die Synthese von Schwefelkohlenstoff.
Eine gängige Methode besteht in der Reaktion von Schwefel mit Methan oder Erdgas bei hohen Temperaturen, wodurch CS2 als Produkt entsteht.
Ein anderer Ansatz besteht darin, Schwefeldampf mit heißer Kohle zur Reaktion zu bringen. Darüber hinaus kann die Kombination von Kohlenmonoxid und Schwefeldampf über einem Katalysator auch Schwefelkohlenstoff erzeugen.
Darüber hinaus kann es zu einer direkten Synthese von CS2 kommen, wenn Kohlenstoff bei erhöhten Temperaturen mit Schwefeldampf reagiert. Im Labor nutzen Chemiker die Reaktion zwischen Kaliumxanthat und Schwefelsäure zur Herstellung von Schwefelkohlenstoff im kleineren Maßstab.
Aufgrund der leicht entzündlichen und toxischen Natur von Schwefelkohlenstoff sind für jede Methode entsprechende Sicherheitsvorkehrungen erforderlich. Die Vielseitigkeit dieser Synthesemethoden ermöglicht verschiedene industrielle Anwendungen, einschließlich ihrer Verwendung als Lösungsmittel, als Rohstoff in chemischen Prozessen und bei der Herstellung von Rayonfasern.
Verwendung von Schwefelkohlenstoff
Aufgrund seiner vielseitigen Eigenschaften findet Schwefelkohlenstoff vielfältige Anwendungsmöglichkeiten. Hier sind einige seiner Verwendungsmöglichkeiten:
- Forschungs- und Laboranwendungen: Laboratorien verwenden Schwefelkohlenstoff als Reagenz für verschiedene chemische Reaktionen, einschließlich der Synthese metallorganischer Verbindungen.
- Extraktion ätherischer Öle: Schwefelkohlenstoff findet Anwendung bei der Extraktion ätherischer Öle aus Pflanzen und erleichtert die Trennung der gewünschten aromatischen Verbindungen.
- Ölgewinnung: Aufgrund seiner Löslichkeit und seines niedrigen Siedepunkts wird Schwefelkohlenstoff in der Industrie zur Gewinnung von Ölen aus Samen und Gemüse verwendet.
- Herstellung von Viskosefasern: Schwefelkohlenstoff spielt bei der Herstellung von Viskosefasern eine entscheidende Rolle, da er dabei hilft, Zellulose aufzulösen, die die Hersteller dann zu synthetischen Fasern für Textilien extrudieren.
- Industrielle Anwendungen: Schwefelkohlenstoff trägt zur Produktion von Pestiziden, Begasungsmitteln und Gummichemikalien bei. Darüber hinaus fungiert es als Katalysator bei der Herstellung von Schwefelsäure und Tetrachlorkohlenstoff.
- Lösungsmittel: Schwefelkohlenstoff dient als Lösungsmittel für eine Vielzahl von Substanzen, darunter Öle, Fette, Gummi, Harze und Schwefel. Daher wird es häufig bei der Herstellung von Produkten auf Zellulosebasis verwendet.
- Chemische Prozesse: Es dient als Rohstoff bei der Synthese organischer Verbindungen wie Tetrachlorkohlenstoff, Thiocarbamate und Dithiocarbamate. Diese Verbindungen finden Anwendung in der Agrar- und Pharmaindustrie.
- Gummivulkanisierung: Schwefelkohlenstoff ist am Vulkanisierungsprozess von Gummi beteiligt und verbessert dessen Festigkeit, Elastizität und Verschleißfestigkeit.
Diese vielfältigen Anwendungen unterstreichen die Bedeutung von Schwefelkohlenstoff in zahlreichen Branchen, von der Textilindustrie über die Landwirtschaft bis hin zu Forschung und Fertigung.
Fragen:
F: Welches der folgenden Moleküle ist polar? A. Ammoniak B. Oktan c. Wasser d. Schwefelkohlenstoff
A: a, Wasser (H2O) ist aufgrund seiner gekrümmten Molekülform und der ungleichen Elektronenverteilung polar.
F: Wie groß ist der Winkel zwischen den Kohlenstoff-Schwefel-Bindungen im Kohlenstoffdisulfid (CS2)-Molekül?
A: Der Winkel zwischen den Kohlenstoff-Schwefel-Bindungen in CS2 beträgt 180 Grad und bildet eine lineare Geometrie.
F: Wie viele Atome enthält insgesamt 1 Mol Schwefelkohlenstoff?
A: Ein Mol Schwefelkohlenstoff enthält 6,02 x 10^23 Moleküle, und jedes Molekül besteht aus 3 Atomen (1 Kohlenstoff und 2 Schwefel).
F: Welches dieser Elemente wäre Ihrer Meinung nach im unpolaren Lösungsmittel Schwefelkohlenstoff CS2 löslich?
A: Unpolare Substanzen wie Octan (b) sollten in Schwefelkohlenstoff (CS2) löslich sein.
F: Was ist der normale Siedepunkt von Schwefelkohlenstoff?
A: Der normale Siedepunkt von Schwefelkohlenstoff liegt bei etwa 46,3 °C (115,3 °F).
F: Ist Schwefelkohlenstoff polar oder unpolar?
A: Kohlenstoffdisulfid (CS2) ist aufgrund seiner linearen Form und der gleichmäßigen Elektronenverteilung ein unpolares Molekül.
F: Wie lautet die Formel für Schwefelkohlenstoff?
A: Die Formel für Schwefelkohlenstoff lautet CS2.
F: Was ist Schwefelkohlenstoff?
A: Kohlenstoffdisulfid (CS2) ist eine flüchtige chemische Verbindung, die aus einem Kohlenstoffatom und zwei Schwefelatomen besteht und in verschiedenen industriellen Anwendungen verwendet wird.
F: Wie wichtig ist die Tatsache, dass Schwefelkohlenstoff dichter als Wasser ist?
A: Die höhere Dichte von Schwefelkohlenstoff im Vergleich zu Wasser bedeutet, dass es sich nicht leicht vermischt und bei der Kombination unterschiedliche Schichten bildet.
F: Wie kann der Mensch mit Schwefelkohlenstoff in Berührung kommen?
A: Menschen können durch industrielle Prozesse, chemische Anwendungen oder den Umgang mit bestimmten Produkten mit Schwefelkohlenstoff in Kontakt kommen.
F: Was passiert, wenn Sie Schwefelkohlenstoff einnehmen?
A: Die Einnahme von Schwefelkohlenstoff kann gesundheitliche Probleme wie Übelkeit, Kopfschmerzen und Auswirkungen auf das Nervensystem verursachen und somit eine Gefahr für die menschliche Gesundheit darstellen.
F: Ist Schwefelkohlenstoff dichter als Wasser?
A: Ja, Schwefelkohlenstoff ist dichter als Wasser, mit einer Dichte von etwa 1,26 g/ml im Vergleich zur Dichte von Wasser von 1 g/ml.
